Потенциал - полуэлемент
Cтраница 2
Чтобы установить приближенную величину потенциала стандартного спиртового полуэлемента экспериментальным путем, были выполнены следующие эксперименты. Последняя концентрация была выбрана потому, что при этих условиях концентрации К и С1 - были одинаковы в спиртовом и водном растворах. [16]
 |
Стандартный электрохимический элемент Вестона. [17] |
Поэтому, если требуется измерить потенциал конкретного полуэлемента, его соединяют с другим полуэлементом, потенциал которого уже известен. Тогда, измеряя потенциал полного электрохимического элемента, можно вычислить потенциал исследуемой полуреакции, которая протекает на конкретном электроде. В качестве условного эталона, с которым производится сопоставление всех окислительных и восстановительных полуреакций, принято использовать стандартный водородный электрод. Так называется полуэлемент, состоящий из платинового электрода, покрытого платиновой чернью, который погружен в 1 М раствор Н, насыщенный газообразным Н2 при давлении 1 атм и температуре 25 С. [18]
Электродвижущая сила любого элемента равна разности потенциалов полуэлементов. [19]
 |
Энергетические соотношения на поверхности раздела между алюминиевым электродом и кристаллом антрацена. Показано, что энергия синглетного экситона Е достаточна для инжекции дырки или электрона. [20] |
Применяя переводной коэффициент для перехода от потенциалов нормального полуэлемента к вакуумному уровню отсчета ( см. разд. Энергия, необходимая для удаления электрона из антрацена, равна 5 8 эВ, так что данная редоксная пара неэффективна в качестве тем-нового инжектора. [21]
При определении элементов, более отрицательных, чем потенциал меркуриодидного полуэлемента, каким и является таллий, платиновый электрод соединяют с отрицательным полюсом аккумулятора; необходимый потенциал устанавливают реостатом и контролируют вольтметром. Ток измеряют гальванометром с ценой деления порядка 10 - 6 а. Титруют раствором KJ при комнатной температуре. [22]
Из уравнения ( 944) следует ожидать значительных изменений потенциалов полуэлементов с изменением растворителей и особенно в связи с изменением основности растворителей. [23]
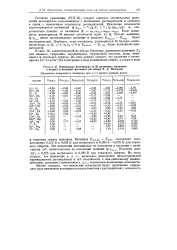 |
Нормальные потенциалы ( в В различных элементов в водных и неводных растворах ( из обзора В. А. Плескова. [24] |
Согласно уравнению ( VIII44), следует ожидать значительных изменений потенциалов полуэлементов с изменением растворителей и особенно в связи с изменением основности растворителей. Изменение основности характеризуется величиной lg YOOCH x / 2lg Kr V2 Ig ( ян2о / ам) и, следовательно, зависит от величины Кг - ам-ан 3о / амн фян2о - Если основность растворителя М меньше основности воды, то К, больше единицы, lg YoocH имеет положительное значение и разность 0 ( н2о) - - о ( м будет положительной. [25]
Можно ожидать, что изменение основности будет однозначно определять знак изменения потенциалов полуэлементов в растворителях, основность которых сильно отличается от основности воды. [26]
Можно ожидать, что изменение ссновности будет однозначно определять знак изменения потенциалов полуэлементов в растворителях, основность которых сильно отличается от основности воды. [27]
Согласно уравнению ( IX, 44), следует ожидать значительных изменений потенциалов полуэлементов с изменением растворителей и особенно в связи с изменением основности растворителей. [28]
В этом уравнении Е0 - константа, зависящая от Ф, от величины потенциала вспомогательного полуэлемента внутри и снаружи стеклянного электрода и от состава жидкости внутри стеклянного электрода. [29]
Из приведенной формулы видно, что с увеличением активности окисленной формы или уменьшением восстановленной - потенциал полуэлемента возрастает. [30]
Страницы: 1 2 3 4