Потенциал - полуэлемент
Cтраница 3
Влияние температуры на потенциал стеклянного электрода определяется изменением сопротивления электрода, изменением потенциала электрода и потенциала образцового полуэлемента. [31]
Электроды сравнения с одним солевым мостиком, в которых для поддержания постоянной концентрации ионов, определяющих потенциал полуэлемента сравнения, и для осуществления контакта с анализируемым раствором используется один и тот же внутренний электролит с малым диффузионным потенциалом. [32]
При изучении протолитических процессов, протекающих в окислительно-восстановительных системах, в качестве нуля отсчета может быть использован потенциал водородного полуэлемента, состав раствора которого практически тот же, что и у раствора окислительно-восстановительной системы. [33]
Потенциал полуэлемента H / GE при постоянной ионной силе определяется уравнением ( 7 - 8), где Е0 зависит от рН внутреннего раствора, потенциала полуэлемента сравнения, потенциала асимметрии мембраны, который незначительно меняется со временем. Область концентраций водородных ионов, в которой уравнение ( 7 - 8) сохраняет силу для данного электрода, зависит от типа стекла и его гидратации. Отклонения чаще всего встречаются в сильнокислых и в щелочных растворах. В последнем случае так называемая щелочная ошибка особенно заметна при высоких концентрациях катионов металлов главной под-групы 1 - й и 2 - й групп, но при применении литиевого стекла она может быть значительно уменьшена. Область рН, в которой уравнение ( 7 - 8) справедливо для электродов, выпускаемых промышленностью, указывается в описании, но ее следует проверить экспериментально через частые интервалы ( стр. [34]
Необходимость предварительного выдерживания электродов в водном растворе обусловлена, на наш взгляд, тем, что величина ПРА А, входящая в выражение ( 3) для потенциала полуэлемента, зависит от состава мембранной фазы и, в частности, от количества воды в ней. Вероятно, равновесное распределение воды между раствором и гаеноч-ной мембраной при комнатной температуре наступает через 10 - 15 сут, При нагревании процесс распределения ускоряется и описанная термообработка приводит к быстрому выходу потенциалов электродов Hi стабильные значения. [35]
Стандартный электродный потенциал ( standard electrode potential) - обрдтимый потенциал электродного процесса, при котором все продукты находятся и все реакции идут при активностях, равных единице; оценивается по шкале, для которой потенциал стандартного водородного полуэлемента равен нулю. [36]
В рассмотренном выше случае окисленной формой является протон, а восстановленной - молекулярный водород. Выражение (13.5) для потенциала полуэлемента носит общий характер. [37]
Разделение в полуэлементах должно быть таким, чтобы не было заметной диффузии. В особенности диффузия не должна сказываться на потенциалах полуэлементов. [38]
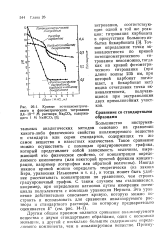 |
Кривые потенцнометриче-ского и фотометрического титрования 3 4 Ю-2 М раствора Na COs, содержащего 1 М NaHCO3. [39] |
Большинство инструментальных аналитических методов основано на сравнении какого-либо физического свойства анализируемого вещества и стандарта или серии стандартов, содержащих то же самое вещество в известных количествах. С таким случаем мы сталкиваемся, например, при определении катионов путем измерения потенциала полуэлемента с помощью уравнения Нернста. [40]
Далее рассмотрим ячейки, составленные из двух полуэлементов, каждый из которых связан с процессом, протекающим на одном из электродов. Следует, однако, подчеркнуть, что работа одного из полуэлементов независимо от другого невозможна, так же как невозможно и измерение потенциала индивидуального полуэлемента. [41]
Потенциалы всех этих полуэлементов имеют отрицательны. В этих полуэлемептах протекают реакции окисления, и в гальванической цепи они отдают электроны, которые перетекают на стандартный водородный электрод, и при этом тем легче, чем больше потенциал полуэлемента по абсолютной величине. [42]
Потенциалы всех этих полуэлементов имеют отрицательный знак. В этих полуэлементах протекают реакции окисления, и в гальванической цеп они отдают электроны, которые переходят на стандартный водородный электрод, и при этом тем энергичнее, чем больше потенциал полуэлемента по абсолютной величине. [43]
Международный союз чистой и прикладной химии ( ИЮПАК) принял решение, что потенциалы полуэлементов4 и электродные потенциалы следует записывать как потенциалы восстановления. Терминами потенциал полуэлемента или электродный потенциал следует обозначать величины, имеющие знак, соответствующий направлению протекания реакции восстановления. [44]
Уравнения электродных процессов для всех полуэлементов пишутся так, что восстановленная форма ( нейтральный атом) стоит в левой части, а электроны и ионы - в правой части уравнения. Схемы гальванических элементов пишутся так, что окислительные электроды, или электроды, на которых электроны выделяются, - помещаются с левой стороны, а восстановительные электроды, или электроды, на которых электроны поглощаются, пишутся с правой стороны. Если сумма потенциалов полуэлементов, расположенных указанным образом, положительна, то реакция, протекающая в элементе, может итти самопроизвольно и свободная энергия системы убывает. Если эта сумма отрицательна, то процесс не может протекать в указанном направлении без применения внешней электродвижущей силы и расхода электрической энергии из некоторого внешнего источника. [45]
Страницы: 1 2 3 4