Потенциал - процесс
Cтраница 2
Можно предположить, что образовавшийся слой продуктов окисления полностью экранирует поверхность стали от активирующего действия роданид-ионов даже при потенциалах процесса питтингообразования на свежем образце. [16]
В некоторых случаях при растворении металла, образующего ионы разной валентности ( степени окисления), бывает невозможно непосредственно измерить потенциал процесса растворения металла. Например, потенциалы процессов Mn - Mn3 - - 3r и Мп - - - - Мп4 ь 4е - не могут быть измерены, так как в обоих случаях металлический марганец восстанавливает оба иона. [17]
 |
Поляризационные кривые при выделении хлора. / - хлор. 2-кислород. 3 -суммарная кри. [18] |
В некоторых случаях при растворении металла, образующего ионы разной валентности ( степени окисления), бывает невозможно непосредственно измерить потенциал процесса растворения металла. [19]
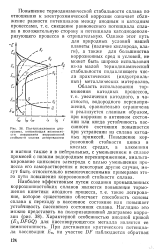 |
Поляризационная диаграмма, поясняющая возможности повышения коррозионной стойкости сплава легированием. [20] |
Повышение термодинамической стабильности сплава по отношению к электрохимической коррозии означает сближение разности потенциалов между анодным и катодным процессами, т.е. смещение равновесного потенциала сплава в положительную сторону и потенциала катоднодеполя-ризующего процесса в отрицательную. [21]
Так как в системе могут иметь место несколько ка-тодных и анодных процессов, мы, как это указано выше, в качестве меры, определяющей, какой из возможных катодных и анодных процессов будет идти, приняли работу разряда или образования одного грамм-эквива-лента ионов, которая может быть определена в виде электрической работы обратимого изотермического процесса: А кР, где А - работа разряда или образования одного грамм-эквивалента, л - потенциал процесса, F - постоянная Фарадея. [22]
 |
Зависимость стандартных окислительно-восстановительных потенциалов восстановителей от рН раствора при 25 С. [23] |
Слева и справа отмечены стандартные потенциалы металлов соответственно в кислой ( рН 0) и щелочной ( рН 14) средах. Значения потенциалов процессов / - 3 рассчитаны нами, остальные взяты из справочных изданий. [24]
В некоторых случаях при растворении металла, образующего ионы разной валентности ( степени окисления), бывает невозможно непосредственно измерить потенциал процесса растворения металла. Например, потенциалы процессов Mn - Mn3 - - 3r и Мп - - - - Мп4 ь 4е - не могут быть измерены, так как в обоих случаях металлический марганец восстанавливает оба иона. [25]
Однако используемая в настоящее время система сбора и хранения отходов бурения несовершенна, она не обеспечивает надежной защиты почвогрунтов, подпочвенных вод и открытых водоемов от проникновения на них загрязнений, несмотря на использование специальных средозащитных мер - обваловку шламовых амбаров и территорий буровой, гидроизоляцию дна и стенок шламовых амбаров и др. Такие амбары являются постоянно действующим источником загрязнения объектов окружающей среды в течение всего цикла строительства скважин, а нередко и после завершения всех работ, так как значительная их часть своевременно не ликвидируется. Все это усиливает загрязняющий потенциал процессов бурения и способствует возникновению напряженной экологической ситуации. Характер негативного влияния отходов на компоненты природной среды определяется прежде всего их загрязняющими свойствами. Последние в значительной мере зависят от вида и природы химреагентов, используемых для обработки буровых растворов. В составе ОБР, БСВ и БШ отмечается повышенное содержание органических веществ всех классов, зачастую высокая концентрация растворимых солей, а также мелкодисперсных и коллоидных глинистых фракций. Кроме того, применяемые как в отечественной, так и в зарубежной практике бурения промывочные жидкости на водной основе содержат нефть и нефтепродукты, относящиеся к числу наиболее опасных и стойких загрязнителей - токсикантов. [26]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-иее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, С г, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [27]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-нее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олоза) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [28]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-нее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [29]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-нее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам откосятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условии электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [30]
Страницы: 1 2 3