Потенциал - процесс
Cтраница 3
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно поло-жительнее, чем - - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно - до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [31]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно поло-жительнее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [32]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно поло-жительнее, чем - 0 41 В, то из нейтрального раствора такого электролита ка катоде будет выделяться металл. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [33]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-нее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [34]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положительное, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду стандартных окислительно-восстановительных потенциалов вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда - приблизительно до титана. [35]
Ион-атом металла, нормально переходящий в раствор при относительно небольшом отклонении потенциала в положительную сторону от равновесного значения, вступает в связь с кислородными ионами, как только потенциал достигает достаточно высоких положительных значений. Однако все попытки отождествить потенциал начала пассивации ( или перехода от пассивного состояния в активное, называемый Фладе-потенциалом) с термодинамическим значением потенциала процесса (8.20) - не привели к успеху. Так, например, для железа, исследованию поведения которого в пассивном состоянии посвящено особенно много работ, термодинамический расчет приводит к следующем величинам нормальных потенциалов трех. [36]
В конце линейного хода кривой потенциал - lg i при поляризации постоянным током в общем случае образуется предельный ток, который, как это видно из рис. 147, делается заметным по отклонению от прямой. Это значит, что наряду с перенапряжением перехода ца возникает еще заметная доля перенапряжения диффузии или реакции. При использовании начальных кривых плотность тока - потенциал процессов включения последние эффекты не возникают, так как % или т ] р при обработке временных функций т) ( t) или i ( t) должны устраняться. [37]
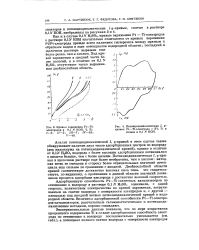 |
Кривые заряжения Pt-Ti - электродов в 0 1 N КОН, % Ti. 1 - 3. Я-5. III-7. IF-10. V-40. [38] |
Анализ потенциодинамической I, ф-кривой в этом случае также обнаруживает наличие двух типов адсорбционных центров по водороду ( два максимума на потенциодинамической кривой), однако в отличие от 0 1N H2SO4 водорода с более высоким адсорбционным потенциалом в щелочи больше, чем с более низким. Потенциодинамическая /, ф-кри-вая в щелочном растворе еще более необратима, чем в кислом: катодная ветвь ее смещена в сторону более отрицательных значений потенциала еще сильнее по сравнению с анодной. Двойнослойной области кривой соответствует достаточно высокая еила тока, что свидетельствует, по-видимому, о протекании в данной области значений потенциала процесса адсорбции кислорода с достаточно высокой скоростью. [39]
Электродные потенциалы металлов, погруженных в водные растворы, определены практически для всех элементов. В табл. 9 приложения электродных потенциалов приведены величины потенциалов, измеренных относительно водородного электрода. В таблицах электродных потенциалов обычно помещают уравнение частной реакции восстановления. Потенциал процесса противоположного направления имеет противоположный знак. Например, электродный потенциал алюминия равен - 1 66 В. Потенциал противоположной реакции 3е - равен 1 66 В. При соединении двух металлов в электрохимическую цепь поток электронов во внешней цепи направляется от электрода с более электроотрицательным стандартным потенциалом восстановления к более положительному. [40]
Электродные потенциалы металлов, погруженных в водные растворы, определены практически для всех элементов. В табл. 9 приложения электродных потенциалов, гриведены величины потенциалов, измеренных относительно водородного электрода. В таблицах электродных потенциалов обычно помещают уравнение частной реакции восстановления. Потенциал процесса противоположного направления имеет противоположный знак. Например, электродный потенциал алюминия равен - 1 66 В. Потенциал противоположной реакции А1ЕьА13 3е - равен 1 66 В. При соединении двух металлов в электрохимическую цепь поток электронов во внешней цепи направляется от электрода с более электроотрицательным стандартным потенциалом восстановления к более положительному. [41]
Выведенные зависимости описывают только те процессы, в которых перенос заряда протекает быстро. Это следует из того, что в решении используется уравнение Нернста, действительное для обратимых процессов. В случае необратимых процессов концентрация продукта электродной реакции не влияет на потенциал, при котором протекает процесс. Поэтому изменение этой концентрации, вызванное последующей реакцией, также не влияет на потенциал процесса. [42]
Описанные выше электроды сравнения 35 - 41 специально рассчитаны на титрование без наложения внешнего напряжения. Титрование без внешнего напряжения удобно с чисто практической стороны, так как оно позволяет упростить схему устдновки: электрическая цепь в этом случае замыкается между индикаторным электродом и электродом сравнения непосредственно через гальванометр. Тем самым из схемы амперометрической установки исключаются внешний источник тока и все приборы, связанные с ним. Кроме того, и нами, и Михальским 38, также работавшим без наложения внешнего напряжения, замечено, что кривые титрования приобретают более четкую форму, если разность потенциалов между катодом и анодом достаточно мала. Этого можно достигнуть, соответствующим образом подбирая электрод сравнения по отношению к потенциалу процесса, протекающего на индикаторном электроде, например: известно, что при титровании цинка ферроцианидом или циркония купфероном с обычным электродом сравнения ( Нас. КЭ) с наложением внешнего напряжения около 1 в титрованию мешает алюминий вследствие пассивации электрода в результате адсорбции коллоидных частиц гидроокиси алюминия. Если же применяется перманганатный электрод сравнения 40, то это явление не наблюдается, разность потенциалов между электродом сравнения и индикаторным электродом составляет всего 0 05 в. При такой небольшой разности потенциалов перенос коллоидных частиц гидроокиси алюминия к аноду меньше, так как перенос заряженных коллоидных частиц, как известно, пропорционален градиенту потенциала. [43]
Описанные выше электроды сравнения 3S - 41 специально рассчитаны на титрование без наложения внешнего напряжения. Титрование без внешнего напряжения удобно с чисто практической стороны, так как оно позволяет упростить схему установки: электрическая цепь в этом случае замыкается между индикаторным электродом и электродом сравнения непосредственно через гальванометр. Тем самым из схемы амперометрической установки исключаются внешний источник тока и все приборы, связанные с ним. Кроме того, и нами, и Михальским 38, также работавшим без наложения внешнего напряжения, замечено, что кривые титрования приобретают более четкую форму, если разность потенциалов между катодом и анодом достаточно мала. Этого можно достигнуть, соответствующим образом подбирая электрод сравнения по отношению к потенциалу процесса, протекающего на индикаторном электроде, например: известно, что при титровании цинка ферроцианидом или циркония купфероном с обычным электродом сравнения ( Нас. КЭ) с наложением внешнего напряжения около 1 в титрованию мешает алюминий вследствие пассивации электрода в результате адсорбции коллоидных частиц гидроокиси алюминия. Если же применяется перманганатный электрод сравнения 40, то это явление не наблюдается, разность потенциалов между электродом сравнения и индикаторным электродом составляет всего 0 05 в. При такой небольшой разности потенциалов перенос коллоидных частиц гидроокиси алюминия к аноду меньше, так как перенос заряженных коллоидных частиц, как известно, пропорционален градиенту потенциала. [44]
Очевидно, условия и особенности развития сложных многокомпонентных систем на неуправляемом участке цепи химико-технологических процессов ( ХТП), с помощью которых осуществляется эволюционный переход, оказывают существенное влияние на качество и условия формирования нефтяного углерода на управляемом участке перехода. В опосредованной форме это влияние проявляется через качество сырья, входящего в управляемый участок цепи ХТП и определяющего его состав, структуру и условия функционирования. Исторически сложилось так, что технология промышленного производства нефтяного углерода основывается на принципе приведения его в соответствие со сложившимися составом и структурой предприятий нефтехимпереработки и прежде всего с неуправляемой, с точки зрения карбонизации частью цепи ХТП как поставщика нефтеуглеродного сырья. Хотя в принципе эволюционный переход от нефти и газа к углероду может быть реализован в полностью управляемой, с точки зрения формирования углерода заданного качества, цепи ХТП; действие отмеченного выше принципа, очевидно, неустранимо и будет иметь место в течение весьма длительного периода. Поэтому важно более активно и полно использовать потенциал процессов неуправляемого участка эволюционного пути в аспекте повышения эффективности и интенсивности процессов формирования нефтяного углерода с заданным составом, структурой и свойствами. Существенным становится увеличение выхода нефтяного углерода на стадии его непосредственного получения как конечного продукта. Все это требует накопления, анализа и обобщения данных по составу, структуре, дисперсности, свойствам, условиям и особенностям технологии формирования сложных многокомпонентных систем на всем пути эволюционного перехода от нефти и газа к углероду. [45]
Страницы: 1 2 3