Потенциал - процесс
Cтраница 1
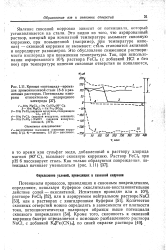 |
Кривые потенциал-время для хромоникелевой стали 18 - 8 в различных растворах. Потенциалы измерены относительно водородного электрода. [1] |
Потенциалы процессов, приводящих к сквозным повреждениям, определяют, используя буферное окислительно-восстановительное действие солей - окислителей. [2]
Реальные, или равновесные, потенциалы процессов окисления - восстановления могут значительно отличаться от стандартных. [3]
Вычисление изменений изохорного и изобарного потенциалов процессов с целью предсказания направления этих процессов является одной из важнейших задач химической термодинамики. [4]
 |
Зависимость скорости коррозии. [5] |
Если при облагораживании потенциала сплава будет достигаться потенциал процесса анодного образования фазового или адсорбционного окисла, то за счет этого будет достигнуто пассивирование и, следовательно, общее уменьшение коррозии. [6]
Аналогично можно определить коэффициент переноса массы Н0 с характеристикой потенциала процесса массо-обмена. К сожалению, нет общей точки зрения на то, какой параметр следует использовать для выражения потенциала переноса. [7]
Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Отсюда ясно, что если электролит образован металлом, электродный потенциал которого значительно положительное, чем - 0 41 В, то из нейтрального раствора у катода будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, в случае электролитов, металл которых имеет потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Сг, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [8]
Скорость фазовых переходов в этом случае вычисляется как произведение коэффициентов массоотдачи ар на разность потенциалов процесса массообмена. [9]
На рис. 16 представлена зависимость выхода по току платины от потенциала осаждения в области потенциалов процесса платинирования от - 0 55 до - 0 90 В. Каждый из исследуемых образцов платинировался потснциостатически в течение 15 мин. В более отрицательной области потенциалов выход по току резко падает, т.к. все большая часть тока идет на процесс выделения водорода. Этот факт еще раз иллюстрирует кри-зая 3 на рис. I - парциальная кривая осаждения платины ва гладком титане. Указанные значения выхода по току носят относительный характер, т.к. соответствуют только взятому нами электролиту. [10]
На рис. 16 представлена зависимость выхода по току платины от потенциала осаждения в области потенциалов процесса платинирования от - 0 55 до - 0 90 В. Каждый из исследуемых образцов платинировался потенциостатически в течение 15 мин. В более отрицательной области потенциалов выход по току резко падает, т.к. все большая часть тока идет на процесс выделения водорода. Этот факт еще раз иллюстрирует кресая 3 на рис. I - парциальная кривая осаждения платины на гладком гитане. Указанные значения выхода по току носят относительный характер, т.к. соответствуют только взятому нами электролиту. [11]
На рис. 16 представлена зависимость выхода по току платины от потенциала осаждения в области потенциалов процесса платинирования от - 0 55 до - 0 90 В. Каждый из наследуемых образцов платинировался потенциостатичеека в течение 15 мин. В боаее отрицательной области потенциалов выход по току резко падает, т.к. все большая часть тока вдет на процесс выделения водорода. Этот факт еще раз иллюстрирует кривая 3 на рис. I - парциальная кривая осаждения платины на гладком гитане. Указанные значвнн, выхода по току носят относительный характер, т.к. соответсавуют только взятому нами электролиту. [12]
На рис. 16 представлена зависимость выхода по току платаны от потенциала осаждения в области потенциалов процесса платинирования от - 0 55 до - 0 90 В. Каждый из исследуемых образцов платинировался потенциостатически г течение 15 мин. В более отрицательной области потенциалов выход по току резко падает, т.к. все большая часть тока адет на процесс выделения водорода. Этот факт еще раз иллюстрирует кри1 - лзя Ъ на рис, I - парциальная кривая осаждения платины на гладком титане. [13]
На рис, 16 представлена зависимость выхода по току платины от потенциала осаждения в области потенциалов процесса платинирования от - 0 55 до - 0 90 В. Каждый из исследуемых образцов платинировался потещиостатически в течение 15 мин. В более отрицательной области потенциалов выход по току резко падает, т.к. все большая часть тока идет на процесс выделения водорода. Этот факт еще раз иллюстрирует кривая 5 на рис. I - парциальная кривая осаждения плагины на гладком гитане. Указанные значения выхода по току носят относительный характер, т.к. ооогветствуют только взятому нами электролиту. [14]
Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно прежде всего учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит, как указывалось выше, от концентрации ионов водорода ( см. стр. Отсюда ясно, что если электролит образован металлом, электродный потенциал которого значительно положительнее, чем - 0 41 В, то из нейтрального раствора у катода будет выделяться металл. Такие металлы находятся в ряду стандартных потенциалов вблизи водорода ( начиная приблизительно от олова) и после него. В случае электролитов, металл которых имеет потенциал значительно более отрицательный, чем - 0 41 В, на катоде будет выделяться водород. К таким металлам относятся металлы начала ряда стандартных потенциалов - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то, в зависимости от концентрации раствора, температуры и плотности тока, возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [15]
Страницы: 1 2 3