Потенциал - равновесие
Cтраница 1
Потенциал равновесия в таком растворе называют абсолютным нормальным электродным потенциалом. Зная абсолютный нормальный потенциал какого-либо электрода, можно вычислить его потенциал относительно раствора любой концентрации. [1]
Потенциалы равновесия Sn / Sn и Sn / Sn для приблизительно равных концентраций станнита и станната в щелочном растворе находятся очень близко друг к другу. [2]
Потенциал равновесия катода в растворе выражается отрезком 0 - 1 на оси напряжения. Участок насыщения, показанный на графике, означает, что при высоком напряжении на катоде ионы не могут поступать к катоду с достаточно высокой скоростью. [3]
Потенциалы равновесия цинка и меди также имеют максимальные значения в присутствии коллоидов в тех же концентрациях, какие дают максимумы поляризации. В опытах для определения потенциалов равновесия электроды были сделаны из прокатанных пластинок чистых металлов или из пластинок, электролитически покрытых соответствующими металлами, причем применялись растворы, не содержащие коллоидов. [4]
 |
Потенциал равном -. равн. 0 0 0581g [ Ag ]. [5] |
Действительно, потенциал равновесия достигается тем быстрее, чем больше по абсолютной величине компенсирующие друг друга силы катодного и анодного тока. Графически это выражается большей или меньшей четкостью пересечения кривых с осью абсцисс. [6]
Для количественного выражения потенциала равновесия часто пользуются стандартным потенциалом электрода. Для этого выбирается стандартный раствор с весовой концентрацией ионов 1: 1000 при температуре 25 С. Условный нуль потенциала выбирается таким образом, чтобы это соответствовало одинаковому выделению водорода с обеих сторон электрода при давлении газа 760 мм. [7]
 |
Схема чередования зон основных реакций в процессе осаждения медной пленки на железную подложку с использованием реакции замещения. [8] |
Как уже отмечалось ранее, потенциалы равновесия существуют как для металлов, так и для электролита. Можно считать, что скорость осаждения ионов одинакова со скоростью ионов, покидающих поверхность катода. Таким образом, если потенциал равновесия отрицателен, то при нулевом напряжении на катоде металл будет переходить в раствор электролита. Если металл с более отрицательной величиной потенциала равновесия погружен в раствор электролита, из которого должно происходить осаждение металла с менее отрицательным потенциалом равновесия, ионы из электролита будут осаждаться на основной металл, а ионы металла будут переходить в раствор. [9]
В процессе электрохимической коррозии приобретают важное значение потенциалы равновесия между металлическим электродом и ионами металла, находящимися в растворе. [10]
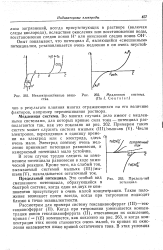 |
Неэлектроактивные веще - [ IMAGE ] 262. Медленная система, ства. ( По J. С о ц г s i e г. [11] |
В этом случае трудно следить за изменением потенциала равновесия в ходе химической реакции. Кроме того, на слабый ток, вызываемый системой мышьяк ( III) / мышьяк ( V), накладывается остаточный ток. [12]
Кроме того, необходимо, чтобы определению потенциала равновесия не ме - - шали другие окислители и восстановители, в том числе и растворитель. [13]
 |
Неэлектроактив-ные вещества.| Медленная система. ( По J. С о u r s i e г. [14] |
В этом случае трудно следить за изменением потенциала равновесия в ходе химической рекции. Кроме того, на слабый ток, вызываемый си стемой мышьяк ( Ш) / мышьяк ( V), накладывается остаточный ток. [15]
Страницы: 1 2 3 4