Потенциал - разложение
Cтраница 2
Потенциал разложения - это минимально необходимая разность потенциалов, при которой начинается электролиз данного соединения. Потенциал разложения также связан с термодинамическими функциями, так как разложить вещество можно, только затратив такое же количество энергии, которое выделилось при его образовании. Поэтому при помощи электролиза из совместного раствора можно выделять какой-либо один ион, обладающий в данных условиях наименьшим потенциалом разложения. [16]
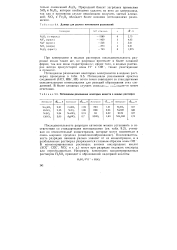 |
Данные для расчета потенциалов разложений.| Потенциалы разложения некоторых веществ в водных растворах. [17] |
Потенциалы разложения некоторых электролитов в водных растворах приведены в табл. 9.5. Потенциалы разложения простых соединений ( НС1, HBr, HI) почти точно совпадают со стандартными окислительными потенциалами для реакций образования этих соединений. В более сложных случаях совпаден с наблюдается менее отчетливо. [18]
 |
Принципиальная схема установки для электролиза ( а. вольт-амперная кривая ( б. [19] |
Потенциал разложения можно определить как минимальное внешнее напряжение, необходимое для того, чтобы вызвать электролиз, проходящий с заметной скоростью. [20]
 |
Схема твердо-мембранного открыто-циклического процесса получения водорода на основе твердого горючего. [21] |
Потенциал разложения при этом снижается на 0 05 - 0 06 В. При использовании деполяризованных анодов аноды и катоды изготовляют из одного и того же материала. [22]
Потенциалы разложения составляют ( при 950 С): для NaF 4 5, для A1F3 3 5-и для А12О3 2 18 в. Эти данные имеют значение в том случае, если анод не взаимодействует с выделяющимися веществами. Если применяют угольный электрод, то потенциал разложения А12О3, теоретически равный 1 00 в ( из-за образования СО), повышается при большой силе тока до 2 в, так как образующаяся СО препятствует разрядке-ионов кислорода. При правильном проведении электролиза натрий никогда не выделяется. Так как значительная часть напряжения, подаваемого на ванну, тратится на преодоление ее омического сопротивления, на практике напряжение на ванне поддерживается около 5 - 6 в при плотности тока 70 - - 90 а на 1 дц % поверхности анода. Как только напряжение начинает заметно возрастать, необходимо добавлять новые порции окиси алюминия. [23]
Потенциалы разложения находят опытным путем. В таблице 18 - 3 приведены соответствующие данные для некоторых электролитов. [24]
Потенциал разложения U связан с энергией Гиб-бса соотношением ( см. гл. [25]
Потенциалы разложения металлов на платине приблизительно равны по величине и обратны по знаку электродным потенциалам этих металлов. [26]
Потенциал разложения U связан с энергией Гиб-бса соотношением ( см. гл. [27]
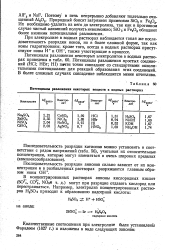 |
Потенциалы разложения некоторых веществ в водных растворах. [28] |
Потенциалы разложения простых соединений ( НС1; HBr; HI) почти точно совпадают со стандартными окислительными потенциалами для реакций образования этих соединений. В более сложных случаях совпадение наблюдается менее отчетливо. [29]
Потенциалы разложения сернокислых и азотнокислых солей одного и того же металла, как это показал опыт с кадмием и другие опыты с щелочными растворами, почти одинаковы; различные же металлы, напротив, обладают различными потенциалами разложения. [30]
Страницы: 1 2 3 4