Потенциал - реакция
Cтраница 1
Потенциал реакции (4.47) положительнее потенциала реакции (4.46) примерно на 400 мВ, теоретическая удельная емкость FeS2 примерно в 1 5 раза выше емкости FeS. Однако FeS2 дороже FeS и менее устойчив, поэтому наряду с электродами из FeS2 и FeS применяют электроды, содержащие смеси этих окислителей. [1]
Потенциал реакции (2.10) зависит от рН среды, в нейтральном растворе он снижается до 0 815 В [10], поэтому при повышении концентрации ионов ОН или снижении концентрации ионов С1 - изменяется соотношение скоростей их разряда и возрастает доля тока, затрачиваемая на выделение кислорода. При наличии в электролите примесей таких ионов, как ОН, СЮ -, СЮЦ, S0 -, HSOj и др., возможны значительные потери выхода по току. [3]
Потенциал реакции ионизации железа во всем интервале изменений рН остается на 50 мв отрицательнее равновесного водородного электрода, рассчитанного для Р н, 1 атм. [4]
 |
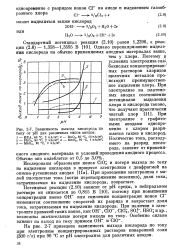
Схематический геоэлектрохимический годограф для однородной пород ы ( а и для пород, вмещающих оруденение ( б. [5] |
Значения потенциалов реакций выдержаны, изменяются в очень малых пределах и почти не зависят от вмещающей среды и генезиса минералов. [6]
Близость потенциалов реакций 1 и 2 ( см. табл. 58) приводит к тому, что на аноде и на катоде одновременно идут обе реакции. [7]
Изменение нзобарно-нзотермического потенциала реакции зависит от температуры протекания реакции. [8]
Величина пзобарно-изотермиче-ского потенциала реакции ( 3) в области температур 800 - 1200 К составляет - 25, - 30 ккал. Сведений о взаимодействии РОС13 с кислородом в расплаве хлористого калия в литературе не обнаружено. [9]
Уравнения потенциалов ионно-электронных реакций позволяют вычислять также и ошибки титрования. [10]
Не только потенциалы реакции, которые протекают непосредственно с участием ионов водорода, но и потенциалы реакций, в которых ионы водорода не участвуют непосредственно, зависят от концентрации ионов водорода. [11]
Не только потенциалы реакции, которые протекают непосредственно с участием ионов водорода, но и потенциалы реакций, в которых ионы водорода не участвуют непосредственно, зависят от концентрации ионов водорода. [12]
Чем выше потенциал реакции разряда, тем легче осуществляется этот процесс. [13]
 |
Прибор для демонстрации окислительно-восстановительного потенциала. [14] |
Вследствие разности потенциалов реакции, связанные с переходом электронов от ионов восстановителя к ионам окислителя, вызывают во внешней цепи прохождение электрического тока. [15]
Страницы: 1 2 3 4