Потенциал - реакция
Cтраница 2
Допустим, что потенциал реакции Pt - Pt2 2е - условно принят равным нулю. [16]
В зависимости от потенциала реакции может меняться контролирующая стадия и вклад того или иного процесса в общую скорость реакции. [17]
Это значительно положительнее потенциала реакций окисления углерода и примерно на 0 1 В положительнее потенциала выделения кислорода. Однако углеродные материалы проявляют высокую эл ектрокаталитическую активность в хлорной реакции. При этом, как будет показано ниже, процесс выделения хлора при сдвиге потенциала в отрицательную сторону непосредственно переходит в процесс его ионизации. Это позволяет реализовать хлорную реакцию в практических условиях, поскольку процессы выделения оксидов углерода и молекулярного кислорода протекают со значительным перенапряжением. [18]
Потенциал реакции (4.47) положительнее потенциала реакции (4.46) примерно на 400 мВ, теоретическая удельная емкость FeS2 примерно в 1 5 раза выше емкости FeS. Однако FeS2 дороже FeS и менее устойчив, поэтому наряду с электродами из FeS2 и FeS применяют электроды, содержащие смеси этих окислителей. [19]
Чатт и Арланд [57] рассмотрели потенциал реакции [ PtL2ClJ 2e 7 [ PtL2Cl2 ] 2Cr и на основании обсуждения индуктивного и электромерного эффектов лиганда пришли к заключению, что ifuc - соединение Pt ( IV) должно восстанавливаться легче, если L является лигандом, способным к образованию двойной связи с платиной. Такой тип лиганда обладает сильным транс-влиянием. [20]
В правой стороне рисунка приведены потенциалы реакций пере хода элементов и. [21]
Возникающий эффект примерно равен разнице потенциалов реакций, идущих на электроде и металлической трубе. [22]
Только при абсолютном нуле изменение изобарно-изотермиче-ского потенциала реакции делается равным изменению энтальпии. На рис. 38 изображены изменения изобарного потенциала и энтальпии реакции в зависимости от температуры. [23]
Итак, действительно, знание знака потенциала реакции позволяет сделать вывод о направлении протекания реакции в данных условиях. [24]
 |
Диаграмма, иллюстрирующая III закон термодинамики. [25] |
Следовательно, при абсолютном нуле изменение изобарно-изотер-мического потенциала реакции ( потенциал Гиббса) становится равным изменению энтальпии. [26]
Рассчитаны приращения энтальпии, энтропии и изобарно-изо-термического потенциала реакций взаимодействия окиси алюминия с окислами бериллия, магния, кальция, стронция и бария; оценены энтальпия, энтропия и потенциал Гиббса образования моноалюминатов элементов второй группы. [27]
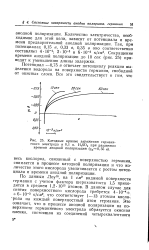 |
Катодные кривые заряжения германиевого электрода в 0 1 н. H2SO4 при различном времени анодной поляризации ( - fa0 35 в. [28] |
Потенциал - 0 75 в отвечает потенциалу реакции выделения водорода на поверхности германия, свободной от окисных слоев. [29]
Как константа равновесия связана с изменением изобарно-изотермическо-го потенциала ДО реакции. [30]
Страницы: 1 2 3 4