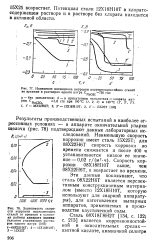
Потенциал - сталь
Cтраница 1
Потенциал стали 12Х18Н10Т в хлорато-содержащем растворе и в растворе без хлората находится в активной области. [2]
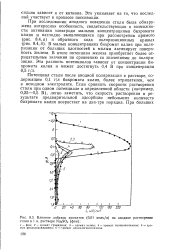 |
Влияние добавок хроматов ( 0 01 моль / л на анодное растворение стали в 1 н. растворе Na2SO4 ( фон. [3] |
Потенциал стали после анодной поляризации в растворе, содержащем 0 1 г / л бихромата калия, более отрицателен, чем в исходном электролите. Если сравнить скорости растворения стали при одном потенциале в определенной области ( например, 0 25 - 0 5 В), легко заметить, что скорость растворения в результате предварительной адсорбции небольших количеств бихромата калия возрастает на два-три порядка. [4]
Потенциал стали в водных вытяжках из ингибиторов М-1 и ВНХ-40 даже при малых концентрациях ингибиторов сдвинут в область положительных значений, а при концентрации от 1 до 5 % остается стабильным. [5]
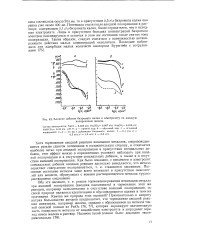 |
Влияние добавок бихромата калия к электролиту на анодную поляризацию железа. [6] |
Потенциал стали после анодной поляризации в растворе, содержащем 0 1 г / л бихромата калия, более отрицателен, чем в исходном электролите. Лишь в присутствии больших концентраций бихромата электрод пассивируется и остается в этом же состоянии после снятия тока поляризации. Таким образом, следует считаться с возможностью активирующего действия малых концентраций окислителя. [7]
Потенциал стали линейно смещается в положительную сторону с ростом логарифма концентрации ингибитора, как в области концентраций, которые увеличивают интенсивность коррозии, так и тех, которые замедляют коррозию. [8]
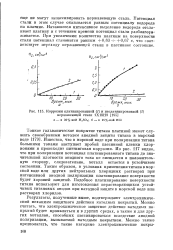 |
Коррозия платинированной ( i и неплатинированной ( 2 нержавеющей стали 1Х18Н9. [9] |
Потенциал стали в этом случае оказывается равным потенциалу водорода на платине. Начавшееся интенсивное выделение водорода отслаивает платину и с течением времени потенциал стали разблагора-живается. При увеличении количества платины на поверхности стали потенциал становится равным 0 63 - f - 0 67 в, что соответствует переходу нержавеющей стали в пассивное состояние. [10]
Если потенциал стали поддерживать постоянным, то приложение механической нагрузки вызывает в конечном итоге заметный рост анодного тока, что формально можно рассматривать как снижение перенапряжения анодного процесса. [11]
Минимум потенциала стали ( и максимум наводороживания) наблюдался нами при некоторой величине растягивающей нагрузки только в случае к а годно поляризованных образцов, что связано, очевидно. [12]
Смещение потенциала стали в отрицательную сторону от значения собственного стационарного потенциала при наложении внешнего катодного тока определяет защиту металла подземного трубопровода. Когда катодная поляризация ( перенапряжение) возникает на металле при прохождении наложенного внешнего тока, растворение или ток коррозии уменьшается, в то время как скорость восстановления увеличивается. На закономерном снижении скорости растворения металлов по мере смещения их электродных потенциалов в отрицательном направлении в области потенциалов более отрицательных, чем стационарный потенциал, основан метод катодной защиты металлов от коррозии. [13]
Смещение потенциала стали при наличии на поверхности № - Р покрытия выше потенциала выделения водорода, что исключает восстановление ионов Н и способствует высокой стойкости покрытий в наводороживающих средах. Для кадмиевого покрытия область пассивности отсутствует, однако анодный процесс растворения затруднен, токи растворения даже при потенциале 100 мВ незначительны. Катодная поляризация наиболее значительна у алюминиевого и цинкового покрытия и уменьшается к кадмиевому и никелевому. [14]
Смещение потенциала стали 12Х18Н10Т в отрицательную область на 75 - 100 mv по отношению к стационарному приводит к значительному повышению скорости коррозии. [15]
Страницы: 1 2 3 4 5