Потенциал - сталь
Cтраница 2
Смещение потенциала стали в отрицательную сторону от значения собственного стационарного потенциала при наложении внешнего катодного тока определяет защиту металла подземного трубопровода. Когда катодная поляризация ( перенапряжение) возникает на металле при прохождении наложенного внешнего тока, растворение или ток коррозии уменьшается, в то время как скорость восстановления увеличивается. На закономерном снижении скорости растворения металлов по мере смещения их электродных потенциалов в отрицательном направлении в области потенциалов более отрицательных, чем стационарный потенциал, основан метод катодной защиты металлов от коррозии. [16]
Резко снижается потенциал стали в растворах хлористого натрия и конденсате. [17]
Если сместить потенциал стали в положительную сторону от стационарного потенциала процесса, то тем самым подавляются катодные реакции на стенках ванны, что дает возможность применить металлическую ванну для химического никелирования. [19]
Опасное значение потенциала стали, характеризующего состояние поверхности раздела образец - среда, зависит от механического напряжения, наличия концентраторов напряжения, химического состава стали, концентрации и температуры щелочной среды. [20]
Анализируя значения потенциалов стали 12Х18Н10Т и ее сварных соединений в различных средах, вызывающих локальную коррозию ( межкристаллитную, ножевую, питтинговую, коррозионное растрескивание, щелевую и контактную коррозию), можно констатировать, что локальные коррозионные процессы развиваются практически во всех областях потенциалов потенциостати-ческой анодной поляризационной кривой. Таким образом, практически при всех потенциалах на поверхности стали могут возникнуть условия, при которых реализуются локальные коррозионные процессы. Ясно, что появление таких условий связано прежде всего с наличием неоднородностей в структуре стали. [21]
При катодной поляризации потенциал стали ОХ21Н6М2Т в аэрируемой уксусной кислоте с примесями НСООН более резко изменяется в начальный период, при дальнейшем увеличении катодного тока потенциал изменяется незначительно и приближается к - 200 мв ( см. фиг. [22]
Ввод Fe3 сдвигает потенциал стали в область пассивного состояния. Сдвиг потенциала в более положительную область за счет высокой концентрации окислителя может привести к активации стали и, следовательно, к увеличению скорости коррозии. [23]
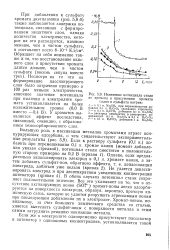 |
Изменение потенциала стали. [24] |
В обоих случаях потенциал стали сохраняет положительное значение. Все это указывает на то, что в отсутствие активирующих ионов ( SO. Хромат-ионам, по-видимому, за счет большего химического средства со сталью, удается вытеснить сульфат-ионы с поверхности металла и этим самым затруднить реакцию ионизации металла. [25]
Наиболее отрицательные значения потенциалов стали наблюдаются в кипящей Н 2SO4 - 100 мв. При таких значениях потенциалов сталь не пассивируется - межкристаллитная коррозия отсутствует, металл корродирует равномерно. Добавление в H2SO4 сернокислой меди резко повышает потенциал стали в растворе ( табл. 2, фиг. Наиболее интенсивная межкристаллитная коррозия наблюдается в растворах, в которых потенциал стали не превышает 600 мв. С увеличением значения потенциала стали возрастает время, нужное для возникновения межкристаллитной коррозии, что, очевидно, связано с необходимостью большего сдвига потенциала для достижения потенциала протекания межкристаллитнсй коррозии. [26]
При увеличении концентрации активатора потенциал стали смещается все более в отрицательную сторону ( рис. 171, кривая 2), что затрудняет адсорбцию хлор-ионов и уменьшает число питтингов, возникающих на поверхности стали. [27]
С увеличением температуры электролита потенциал стали в 18 % - ной Н2 04 сдвигается в положительную сторону ( фиг. [28]
В табл. 20 приведены потенциалы сталей 06Х17Г15БАН и 12Х18Н10Т в растворах азотной кислоты в зависимости от концентрации и температуры растворов. Когда стали близки по коррозионной стойкости ( 45 и 65 % - ная HNO3, 60 C), близки и значения их потенциалов, отвечающие пассивному состоянию. [29]
При увеличении концентрации активатора потенциал стали смещается все более в отрицательную сторону ( рис. 171, кривая 2), что затрудняет адсорбцию хлор-ионов и уменьшает число питтингов, возникающих на поверхности стали. [30]
Страницы: 1 2 3 4 5
