Потенциал - цинк
Cтраница 1
Потенциал цинка в зависимости от температуры изменяется значительно быстрее и на большую величину, чем потенциал железа, достигая значений от - 0 36 до - 0 25 В. При понижении температуры значение потенциала восстанавливается, причем особенно быстро в присутствии хлоридов. При длительном воздействии горячей воды значение начального потенциала при понижении температуры не восстанавливается и он сохраняет свою изменившуюся величину. [1]
Потенциал цинка в растворе собственных ионов является равновесным и для системы Zn / Zn2 cp 0 763 в; термический и изотермический температурные коэффициенты потенциала составляют соответственно 0 962 и 0 091 ме / град. Цинк относится к группе металлов, разряд и ионизация которых происходят сравнительно легко. [2]
 |
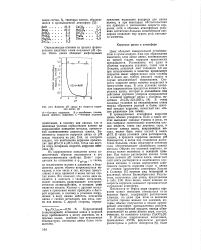
Локальные токи при растворении цинка с включением из меди ( а и поляризационные кривые локального элемента ( б. [3] |
Потенциал цинка смещается в анодную сторону, что приводит к ускорению анодного растворения цинка и уменьшению скорости выделения водорода на цинке. В то же время на поверхности включения происходит интенсивное выделение водорода. Кривая / характеризует анодное растворение основного металла, кривая 2 - выделение водорода на этом металле. Поэтому фактически коррозионный процесс зависит от скорости анодного растворения металла и выделения водорода на включении. Реакции, которым отвечают кривые / и 3, протекают на разных по размеру участках поверхности. Так как суммарная сила катодного тока должна равняться суммарной силе анодного тока, плотности катодного и анодного токов не равны. Величина / х характеризует максимальный ток локального элемента. [4]
Потенциал цинка в зависимости от температуры изменяется значительно быстрее и на большую величину, чем потенциал железа, достигая значений от - 0 36 до - 0 25 В. При понижении температуры значение потенциала восстанавливается, причем особенно быстро в присутствии хлоридов. При длительном воздействии горячей воды значение начального потенциала при понижении температуры не восстанавливается и он сохраняет свою изменившуюся величину. [5]
Потенциал цинка смещается в анодную сторону, что приводит к ускорению анодного растворения цинка и уменьшению скорости выделения водорода на цинке. В то же время на поверхности включения происходит интенсивное выделе-ние водорода. [6]
Изменение потенциала цинка в горячей водопроводной воде до - 0 3 В и - 0 25 В, свидетельствующее о протекании на отдельных участках металлической поверхности коррозионного процесса под анодным контролем, вызвано наличием определенных условий, например присутствием в воде кислорода или бикарбонатов. [7]
Такая величина потенциала цинка идеальна для морской воды или других электролитов с низким удельным электрическим сопротивлением, но применение цинка в средах с более высоким удельным сопротивлением не всегда оправдано. [8]
С, так как потенциал цинка по отношению к железу меняет свой знак при более высокой температуре. [9]
Sn-Bi; потенциал олова потенциал цинка принят равным нулю. [10]
С, так как потенциал цинка по отношению к железу меняет свой знак при более высокой температуре. [11]
Вычислить при 25 С потенциал цинка, погруженного в 0 1 М раствор ZnSC4, и потенциал этого электрода, погруженного в этот же раствор, разбавленный в 10 раз. [12]
Вычислить при 25 С потенциал цинка, погруженного в 0 1 М раствор ZnSO4, и потенциал этого электрода, погруженного в этот же раствор, разбавленный в 10 раз. [13]
 |
Влияние рН среды на скорость коррозии цинка. [14] |
Коррозионный ( стационарный) потенциал цинка в морской воде приближается к этому значению, но в пресных водах, особенно при повышенных температурах, потенциал цинка более положителен. [15]
Страницы: 1 2 3 4