Потенциал - электрод
Cтраница 1
Потенциал электрода в растворе зависит не только от природы металла, но и от концентрации раствора. [1]
Потенциалы электродов, через которые проходит электрический ток, отличаются от потенциалов электродов, не нагруженных током; замыкание цепи в коррозионном элементе приводит к изменению величин начальных потенциалов электродов. При условии, что омическое сопротивление элемента R мало, значение коррозионного тока / Нач после замыкания пары быстро падает и через определенное время становится равным устойчивой величине /, которая во много раз меньше первоначальной. [2]
 |
Водородный электрод.| Хлорсеребряный электрод. [3] |
Потенциалы электродов для условий, отличных от стандартных, рассчитывают по уравнению В. [4]
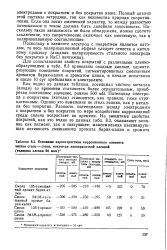 |
Основные характеристики коррозионного элемента чистая сталь - сталь, покрытая лакокрасочной пленкой ( толщина пленки 20 мкм. [5] |
Потенциал электрода с покрытием ( катода) становится, как правило, тоже отрицательным. Однако это изменение не столь велико, как у металла без покрытия. Разность потенциалов между электродами с покрытием и без покрытия по мере воздействия коррозионной среды сильно возрастает во времени. [6]
Потенциалы электродов, у которых в процессе взаимодействия металла и электролита участвуют не только собственные, но и другие ионы и атомы, являются необратимыми или неравновесными электродными потенциалами. Они не подчиняются термодинамическому уравнению ( 63), следовательно, их нельзя рассчитать, а можно определить только опытным путем. [7]
Потенциал электрода, через который проходит ток, отличается от потенциала электрода, не нагруженного током. [8]
Потенциал электрода влияет на заряд поверхности катода, изменяет условия адсорбции молекул. Органические вещества в большинстве своем малополярные и лучше адсорбируются на незаряженной поверхности в область потенциала нулевого заряда. Область адсорбции неорганических веществ, часто хорошо диссоциирующих в ионизирующих растворителях, определяется зарядом восстанавливаемого иона. [9]
Потенциал электрода под током ez в общем случае не равен равновесному электродному потенциалу ег и его нельзя вычислить термодинамически. Величина его зависит не только от природы системы, ее температуры и давления, но и от силы тока. [10]
Потенциал электрода под током е / в общем случае не равен равновесному электродному потенциалу ег, и его нельзя вычислить термодинамически. Величина его зависит не только от природы системы, температуры и давления, но и от силы тока. [11]
Потенциал электрода в этих условиях называется обратимым или равновесным электродным потенциалом. Величину равновесного электродного потенциала ( в условной шкале) можно вычислить при помощи общих термодинамических уравнений, если только известны электродная реакция, активности участвующих в ней веществ, температура и давление. [12]
Потенциал электрода под током е / в общем случае не равен равновесному электродному потенциалу ег и его. Величина его зависит не только от природы системы, температуры и давления, но и от силы тока. [13]
Потенциал электрода е / и электродная поляризация Де являются прежде всего функциями силы тока и при его отсутствии равны соответственно равновесному потенциалу ег и нулю. [14]
Потенциал электрода равен его равновесному значению, т.е. е ег. [15]
Страницы: 1 2 3 4