Потенциал - электрод
Cтраница 4
Потенциал электрода обычно измеряется компенсационным методом для избежания ошибки, связанной с поляризацией электрода сравнения. Однако в ряде случаев компенсационный метод не удобен для исследования, в частности, когда потенциал быстро меняется во времени и возникает необходимость фиксировать изменение потенциала в процессе электролиза. В этом случае потенциал определяется методом непосредственного измерения разности потенциалов между определенным электродом и электродом сравнения при помощи чувствительного прибора. [46]
Потенциал электрода соответствует уравнению (VII.5), если: 1) растворимость MS больше, чем Ag2S, и в то же время достаточно мала по сравнению с солями, образуемыми ионами в исследуемом растворе; 2) равновесия, описываемые уравнениями ( VII. [47]
Потенциал электродов с жидкими мембранами на основе триптофана и фенилаланина линейно зависел от концентрации в пределах 10 1 - Ю-2-7 М, 8Э 55 мВ / lg С; для лейцин-селективного электрода 5Э 57 мВ / lg С. [48]
Потенциал электрода при электролизе непрерывно изменяется в зависимости от количества пропущенного электричества или ( при поляризации током постоянной силы) от времени. Кривые зависимости потенциала от количества электричества, сообщенного электроду, называются кривыми заряжения. [49]
 |
Строение двойного электрического слоя. [50] |
Потенциал электрода в растворе зависит не только от природы металла, но и от концентрации раствора. [51]
Потенциалы электродов и величины эмиссионных токов близки к тем, которые имеют место в триодных конструкциях с цилиндрическим коллектором. Центральный проволочный коллектор собирает большую часть положительных ионов, образовавшихся внутри области, ограниченной спиралью сетки. Но при этом для рентгеновских лучей с сетки он расположен в очень узком телесном угле, на два-три порядка величины меньшем по сравнению с тем, который имеет место в триодной лампе. [52]
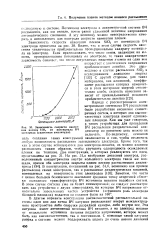 |
Зависимость скорости нанесения пленок SiOg от потенциала ВЧ электрода ( удвоенная амплитуда. [53] |
Потенциал электрода в асимметричной системе ВЧ распыления, как мы видели, почти равен удвоенной величине напряжения автоматического смещения. [54]
Потенциал электрода, как следует из уравнения, не зависит oi кислотности раствора. Однако при уменьшении кислотности начнет существенно сказываться гидролиз соли трехвалентного железа, гидролизующегося значительно сильнее, чем соль двухвалентного железа. [55]
Потенциалы электродов выражены в единицах потенциала первого электрода. [56]
Страницы: 1 2 3 4