Потенциал - индикаторный электрод
Cтраница 2
 |
Каломельный электрод. [16] |
Потенциал индикаторного электрода определяют, сравнивая его с потенциалом другого электрода, который принято называть электродом сравнения. В качестве электрода сравнения может быть применен только такой электрод, потенциал которого остается неизменной при изменении концентрации определяемых ионов. В качестве электрода сравнения применяют стандартный ( нормальный) водородный электрод ( см. книга I, гл. [17]
 |
Кривая потенциометрического титрования AgNO3 раствором NaCl.| Кривая потенциометри-ческого титрования AgNO3 раствором NaCl, построенная в системе координат ДЕ / ДС. [18] |
Потенциал индикаторного электрода функционально связан с концентрацией ионов водорода. [19]
 |
Изменение потенциала платинового индикаторного электрода при титровании 25 00 мл 0 1000 М раствора железа ( П 0 1000 М раствором церияПУ. [20] |
Обозначим потенциалы индикаторного электрода и каждой полуреакции ( записанной как реакция восстановления) в точке эквивалентности через тэ. [21]
Поскольку потенциал индикаторного электрода до точки эквивалентности связан с [ А. [22]
Величину потенциала индикаторного электрода определяют, сравнивая ее с величиной потенциала другого электрода, который принято называть электродом сравнения. В качестве электрода сравнения может быть применен только такой электрод, величина потенциала которого остается неизменной при изменении концентрации определяемых ионов. В качестве электрода сравнения применяют нормальный водородный электрод ( см. книга I, Качественный анализ, гл. [23]
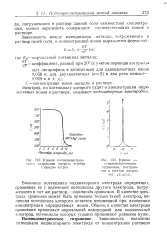 |
Кривая потенпиометриче.| Кривая iju. [24] |
Величину потенциала индикаторного электрода определяют, сравнивая ее с величиной потенциала другого электрода, погруженного в тот же раствор-электрода сравнения. В качестве электрода сравнения может быть применен только такой электрод, величина потенциала которого остается неизменной при изменении концентрации определяемых ионов. Обычно в качестве электрода сравнения применяют нормальный водородный или каломельный электрод, потенциалы которых условно принимают равными нулю. [25]
Величину потенциала индикаторного электрода определяют, сравнивая ее с величиной потенциала другого электрода, который принято называть электродом сравнения. В качестве электрода сравнения может быть применен только такой электрод, величина потенциала которого остается неизменной при изменении концентрации определяемых ионов. Обычно в качестве электрода сравнения применяют нормальный водородный электрод ( см. Качественный анализ, гл. [26]
Постоянство потенциала индикаторного электрода обеспечивает высокую избирательность процесса по отношению к определяемому веществу. [27]
 |
Зависимость сдвига потенциала индикаторного медного электрода Дф от объемной концентрации одновалентной меди. [28] |
Сдвиг потенциала индикаторного электрода при высоких и низких объемных концентрациях ионов Си несовместим также с механизмом ( 55) с быстрой химической реакцией, поскольку в этом случае, как уже упоминалось выше, потенциал должен был бы оставаться постоянным. [29]
Зависимость потенциала индикаторного электрода от концентрации раствора может быть использована для определения точки эквивалентности при титровании. В точке эквивалентности, когда концентрация определяемого иона сильно уменьшается и становится практически ничтожной, происходит резкое изменение потенциала, регистрируемое гальванометром. [30]
Страницы: 1 2 3 4 5