Потенциал - индикаторный электрод
Cтраница 3
Выбор потенциала индикаторных электродов зависит от конкретной аналитической задачи. [31]
Зависимость потенциала индикаторного электрода Е, измеренного относительно электрода сравнения, от объема прибавленного титранта представляет собой интегральную кривую титрования. [32]
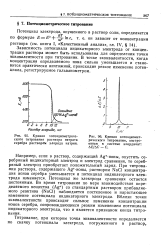 |
Кривая потенциометриче-ского титрования раствора нитрата серебра растворам хлорида натрия.| Кривая потенциомет-рического титрования, построенная в системе координат. Л. / ДС - С. [33] |
Зависимость потенциала индикаторного электрода от концентрации раствора может быть использована для определения точки эквивалентности при титровании. В точке эквивалентности, когда концентрация определяемого иона сильно уменьшается и становится практически ничтожной, происходит резкое изменение потенциала, регистрируемое гальванометром. [34]
 |
Каломельный электрод. [35] |
Величину потенциала индикаторного электрода определяют, сравнивая ее с величиной потенциала другого электрода, который принято называть электродом сравнения. В качестве электрода сравнения может быть применен только такой электрод, Величина потенциала которого остается неизменной при изменении концентрации определяемых ионов. Обычно в качестве электрода сравнения применяют нормальный водородный электрод ( см. книга 1, гл. [36]
 |
Каломельный остается неизменной при изменении концентра-электрод. ции определяемых ионов. Обычно в качестве. [37] |
Величину потенциала индикаторного электрода определяют, сравнивая ее с величиной потенциала другого электрода, который принято называть электродом сравнения. [38]
Величину потенциала индикаторного электрода определяют, сравнивая ее с величиной потенциала другого электрода, который принято называть электродом сравнения. В качестве электрода сравнения может быть применен только такой электрод, величина потенциала которого 76 Каломельный остается неизменной при изменении концентрации определяемых ионов. [39]
Во-первых, потенциал индикаторного электрода должен быть связан через уравнение Нернста с активностью определяемых частиц. Это требование особенно важно в методе прямой потенциометрии. Во-вторых, желательно, чтобы отклик индикаторного электрода был бы быстрым и воспроизводимым при изменении активности интересующего нас вещества. В-третьих, индикаторный электрод должен иметь такую внешнюю форму, которая позволила бы легко проводить измерения. [40]
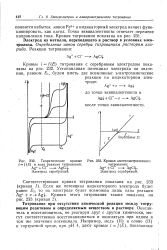 |
Теоретические кривые l f ( E в ходе реакции титрования.| Кривая амперометрического. [41] |
Если же потенциал индикаторного электрода будет равен EZ, то на электроде будет возможна лишь одна реакция Ag е - Agj. [42]
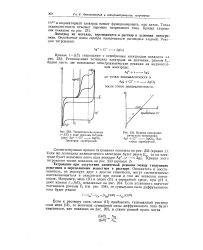 |
Теоретические кривые / (. в ходе реакции титрова.| Кривая амперомет. [43] |
Если же потенциал индикаторного электрода будет равен Е2, то на электроде будет возможна лишь одна реакция Ag 4 е - - AgJ. [44]
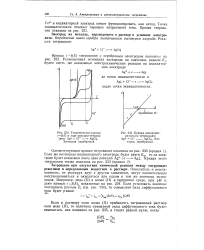 |
Теоретические кривые / (. в ходе реакции титрова.| Кривая амперомет-рического титрования. [45] |
Страницы: 1 2 3 4 5