Потенциал - измерительный электрод
Cтраница 1
Потенциал измерительного электрода из благородного металла, равный окислительно-восстановительному потенциалу системы бром-бромид, является мерой концентрации свободного брома в растворе и служит для поддержания этой концентрации на заданном уровне. [1]
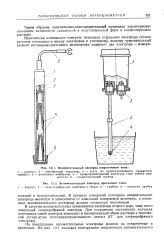 |
Вспомогательный электрод непроточного типа.| Вспомогательный электрод проточного типа. [2] |
В процессе измерений потенциал измерительного электрода меняется в зависимости от изменений измеряемой величины, а потенциал вспомогательного электрода должен оставаться постоянным. [3]
Строят градуировочный график зависимости потенциала измерительного электрода ( Е, мВ) от отрицательного логарифма концентрации хлорид-иона ( рС1 -) по средним результатам измерений пяти серий градуировочных растворов. Проверку графика проводят по нескольким точкам в день анализа проб. [4]
При нормальной работе разность потенциалов измерительных электродов поддерживается несколько ниже значения опорного напряжения. При этом фаза напряжения сигнала совпадает с фазой напряжения питания триодов ПП и ПП2, и в цепи электродов электролиза протекает постоянный ток. При обратной полярности сигнала на входе в усилитель напряжение сигнала и напряжение питания триодов находятся в противофазе, ток в цепи коллектора триода и, следовательно, в цепи электродов электролиза отсутствует. [5]
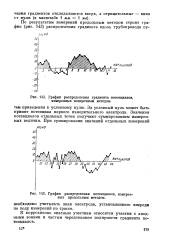 |
График распределения градиента потенциалов, измеренных поперечным методом.| График распределения потенциалов, измеренных продольным методом. [6] |
За условный нуль может быть принят потенциал первого измерительного электрода. Значения потенциалов отдельных точек получают суммированием измеренных величин. [7]
 |
Схема автоматического анализатора остаточного хлора типа КОХ-1. [8] |
Вспомогательный электрод служит для поддержания постоянства потенциала измерительного электрода. Кроме этого, для поддержания постоянства потенциала измерительного электрода в системе прибора применяется электронное устройство - потенциостат. Так как в приборе напряжение подается на электроды ( что приводит к разложению аминов), он может измерять концентрацию всего хлора, присутствующего в воде, с учетом связанного хлора без введения реагента. [9]
 |
Упрощенная схема рН - метра с прерывателем на входе. [10] |
Предположим теперь, что вход усилителя разомкнут и потенциал измерительного электрода выше потенциала опорного электрода. [11]
Следовательно, внешнее напряжение полностью расходуется на сдвиг потенциала измерительного электрода. Для определения потенциала электрода при протекании тока в уравнение Нернста подставляют концентрацию реагирующего вещества у поверхности электрода. [12]
При изменении содержания SO2 в газе и соответственно содержания йода в растворе изменяется разность потенциалов измерительных электродов и на вход электронного усилителя поступает сигнал, равный разности между заданным опорным напряжением и разностью потенциалов измерительных электродов. В зависимости от величины и направления этого сигнала изменяется напряжение постоянного тока на выходе усилителя, которое подается на электроды цепи электролиза. [13]
При изменении содержания SO2 в газе и соответственно содержания йода в растворе изменяется разность потенциалов измерительных электродов и на вход электронного усилителя поступает сигнал, равный разности между заданным опорным напряжением и разностью потенциалов измерительных электродов. В зависимости от величины и направления этого сигнала изменяется напряжение постоянного тока на выходе усилителя, которое подается на электроды цепи электролиза. [14]
При изменении содержания сернистого ангидрида, а следовательно, и иода в растворе изменяется разность потенциалов измерительных электродов 2 и 3 ( 3 и 4 на рис. 49) и на вход усилителя 5 ( на этом же рисунке) поступает сигнал, равный разности между заданным опорным напряжением и разностью потенциалов измерительных электродов. В зависимости от величины и направления сигнала на выходе усилителя изменяется напряжение постоянного тока, которое подается на электроды / и 2 цепи электролиза. Это вызывает изменение тока электролиза, а следовательно, и количества генерируемого иода, необходимого для окисления сернистого ангидрида. [15]
Страницы: 1 2 3