Потенциал - водородный электрод
Cтраница 3
Измеряя потенциал водородного электрода можно с помощью уравнения ( 37), определить рН раствора. [31]
Измерив потенциал водородного электрода, можно при помощи уравнения ( 37) определить рН раствора. [32]
Вычислить потенциал водородного электрода в растворе, 1 л которого содержит 5 61 г КОН. [33]
Рассчитайте потенциал водородного электрода, в котором концентрация ионов водорода равна 1 г-ион / л, а парциальные давления водорода равны 0 1, 1 и 10 атм. [34]
 |
Водородный электрод. [35] |
Измерив потенциал водородного электрода, можно при помощи уравнения ( 45) определить рН раствора. [36]
Величина потенциала водородного электрода условно приравнивается к нулю. [37]
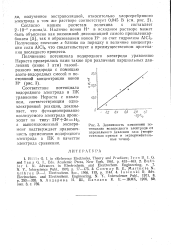 |
Зависимость изменения потенциала водородного электрода от парциального давления газа ( теоретическая прямая и экспериментальные точки. [38] |
Соответствие потенциала водородного электрода в ПК уравнению Нернста с наклоном, соответствующим одно-электронной реакции, доказывает, что функционирование исследуемого электрода происходит по типу: 2Н 2е - Н2, а вышеизложенный эксперимент подтверждает правомочность применения водородного электрода в ПК с качестве электрода сравнения. [39]
Выбор потенциала водородного электрода в качестве нулевой точки при измерениях электродных потенциалов в различных растворителях является чисто условным. Тем не менее, следует ожидать, что свободная энергия будет изменяться при переносе иона рубидия из одного растворителя в другой даже в отсутствие значительной сольватации, если отличаются значения диэлектрической проницаемости растворителей. Составляющая свободной энергии, отвечающая переносу иона, в первом приближении обратно пропорциональна ионному радиусу и, по-видимому, незначительна для очень больших ионов. Стрелов [55, 56] при вычислениях с использованием видоизмененного уравнения Борна принимал в расчет возникающие по этой причине различия в стандартном потенциале. [40]
Повышение потенциала водородного электрода делает последний менее благородным, что равносильно усилению восстановляю-щего действия водорода. Поэтому выделяющийся на платине водород является менее энергичным восстановителем, чем например выделяющийся на ртути. Аналогичное восстановление нитробензола до анилина требует применения свинцовых или ртутных катодов, а при платиновых катодах идет восстановление лишь до / 7-аминофенола. Наоборот, платиновые аноды с повышенным перенапряжением кислорода благоприятствуют реакциям окисления. [41]
Воспроизводимость потенциала водородного электрода может быть хорошей только при соблюдении определенных условий: применение в высокой степени чистого электролита и водорода, определенная глубина погружения электрода и нагрузка электрода малыми токами. [42]
Выбор потенциала водородного электрода в качестве нулевой точки при измерениях электродных потенциалов в различных растворителях является чисто условным. Тем не менее, следует ожидать, что свободная энергия будет изменяться при переносе иона рубидия из одного растворителя в другой даже в отсутствие значительной сольватации, если отличаются значения диэлектрической проницаемости растворителей. Составляющая свободной энергии, отвечающая переносу иона, в первом приближении обратно пропорциональна ионному радиусу и, по-видимому, незначительна для очень больших ионов. Стрелов [55, 56] при вычислениях с использованием видоизмененного уравнения Борна принимал в расчет возникающие по этой причине различия в стандартном потенциале. [43]
Разность потенциалов водородного электрода и гладкой платины зависит в одном том же растворе только от разности давлений водорода над электродами. [44]
Чему равен потенциал водородного электрода при рН 10: а) - 0 59В; б) - О. [45]
Страницы: 1 2 3 4