Потенциал - стандартный водородный электрод
Cтраница 3
 |
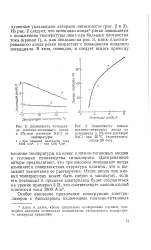
Потенциалы каломельных электродов при температурах от 5 до 50 С. [31] |
Все значения потенциалов каломельных электродов даны по отношению к значениям потенциала стандартного водородного электрода. [32]
 |
Стандартный электрохимический элемент Вестона. [33] |
Окислительно-восстановительный потенциал любой полуреакции может быть измерен путем сравнения с потенциалом стандартного водородного электрода. Например, стандартный электродный потенциал цинка можно измерить с помощью прибора, изображенного на рис. 16.5, где цинковый электрод погружен в 1 М раствор Zn2 при 25 С. [34]
Здесь и далее, кроме специально оговоренных случаев, приведены значения потенциала относительно стандартного водородного электрода сравнения. [36]
Положительный потенциал ( positive potential) - потенциал более положительный, чем потенциал стандартного водородного электрода. [37]
В настоящее время общепринятой является шкала, в которой за нуль выбран потенциал стандартного водородного электрода. В этом электроде активность ионов водорода в растворе и фугитивность газообразного водорода над раствором равны единице. [38]
Все значения электродных потенциалов выражены в вольтах и даны по отношению к потенциалу стандартного водородного электрода при соответствующей температуре. [39]
Благородный потенциал ( noble potential) - потенциал, более положительный, чем потенциал стандартного водородного электрода. [40]
Стандартный электродный потенциал имеет положительный знак, если его потенциал более положителен, чем потенциал стандартного водородного электрода, и отрицательный знак, если его потенциал более отрицателен, чем водородный. При этом положительным является электрод, на котором происходит восстановление, а отрицательным такой, на котором происходит окисление. Согласно принятой системе знаков процесс самопроизвольно протекает тогда, когда ЭДС элемента положительна. [41]
Электролитическое осаждение кадмия из сульфатных электролитов происходит при потенциалах-0 5 - 0 6 в относительно потенциала стандартного водородного электрода. Поэтому электрохимическое восстановление кадмия совершается на электроде, поверхность которого имеет небольшой отрицательный заряд, близкий к нулю. [42]
В соответствии с Европейским соглашением, стандартному потенциалу приписывается знак минус, если потенциал отрицателен относительно потенциала стандартного водородного электрода. Американского соглашения характеризуют осуществимость полуреакции, ее направление. [43]
В настоящее время для вычисления условных электродных потенциалов пользуются водородной шкалой, в которой при всех температурах за нуль выбран потенциал стандартного водородного электрода с активностью водородных ионов в растворе, равной единице, и давлением водорода, равном 1 атм. [44]
Поскольку не существует никакого метода измерения абсолютного значения потенциала только одного электрода, в качестве произвольной нулевой точки был выбран потенциал стандартного водородного электрода. Условно принято, что потенциал водородного электрода равен нулю, когда давление водорода равно 1 атм и активность ионов Н в растворе равна единице. [45]
Страницы: 1 2 3 4