Потенциал - кислородный электрод
Cтраница 1
Потенциал кислородного электрода, согласно уравнению ( 13) гл. [1]
Потенциалы кислородного электрода показывают, что первичным процессом на нем является образование перекиси водорода, которая под влиянием катализаторов разлагается с выделением кислорода, вновь используемого в элементе. [2]
Потенциал кислородного электрода симбатно зависит от парциального давления кислорода в газовой фазе, причем повышение потенциала электрода на / 2Ф достигается при повышении Ро2 ( точнее, активности кислорода) в 100 раз. Следовательно, кислородный электрод менее чувствителен к изменению давления газа, чем водородный. [3]
Зависимость потенциала кислородного электрода от рН имеет вид прямой с наклоном - 0 0591 в на единицу рН, как в случае водородного электрода. Как показывает (4.21), увеличение Ю на единицу ( что означает уменьшение парциального давления кислорода на целый порядок) сопровождается уменьшением потенциала кислородного электрода на величину, близкую к 15 мв. [4]
Зависимость потенциала кислородного электрода от рН имеет вид прямой с наклоном - 0 0591 в на единицу рН, как в случае водородного электрода. [5]
Величина потенциала нормального кислородного электрода при рН14 принимается равной 0 41 в. [6]
Величины потенциалу кислородного электрода, полученные опытным путем, поэтому обычно не совпадают с теоретическими. [7]
 |
Схема поляризационного поведения системы Р1 РЮ 02приф Фом, / см / - /. при всех других значениях фа / / - /. [8] |
Теоретическое значение потенциала кислородного электрода было получено лишь при специальных условиях подготовки электрода и очистки раствора. [9]
По отношению к этому значению потенциал кислородного электрода равен 0 810 в. Так как изменение представляет разность между потенциалами электродов, то разность в 1 23 в заключает ре-докспотенциалы всех биохимических окислительно-восстановительных систем, лежащих в основе жизненных процессов. [10]
Однако этот потенциал не совпадает с потенциалом кислородного электрода. Причиной такого отклонения могут служить наличие собственного коррозионного растворения металла ( так как титан не может быть полностью инертным, особенно в кислой области рН), а также наличие в растворе посторонних примесей. [11]
Этот процесс не будет протекать, если потенциал кислородного электрода уменьшится до - 0 30 В. [12]
В качестве нулевой точки шкалы потенциалов принимают потенциал кислородного электрода в системе HNO3 - N2O4 - H2O при 25 и при 1 0 ата парциального давления кислорода над системой. Потенциал йодного полуэлемента относительно принятого нуля равен - 47 0 5 0 мв. [13]
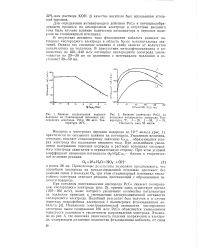 |
Влияние концентрации перекиси [ IMAGE ] Влияние количества РсСо на. [14] |
В отсутствие внешнего тока фталоцианин кобальта смещает потенциал кислородного электрода в область более положительных значений. Однако это смещение невелико и слабо зависит от количества катализатора на подложке. [15]
Страницы: 1 2 3 4