Потенциал - кислородный электрод
Cтраница 3
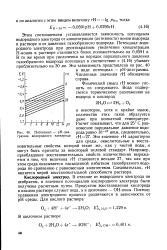 |
Потенциал - рН - диа-грамма водородного электрода. [31] |
В отличие от водородного электрода он необратим, и значения потенциалов кислородного электрода были получены расчетным путем. Продуктом восстановления кислорода в кислом растворе служит вода, а в щелочном - ОН-ионы. Поэтому уравнения электродного процесса различаются в зависимости от рН среды. [32]
Причина образования коррозионного элемента неравномерной аэрации заключается в том, что потенциал кислородного электрода зависит от концентрации кислорода в растворе. С повышением концентрации кислорода потенциал кислородного электрода становится более положительным. [33]
Уравнения (5.11) и (5.16) удовлетворительно объясняют экспериментально установленные соотношения, для зависимости потенциала кислородного электрода от плотности тока, парциального давления кислорода над раствором и от концентрации водородных ионов. [34]
Последняя в нейтральном растворе лишь на 0 03 в более положительна, чем потенциал кислородного электрода. Таким образом, можно предположить, что in vivo полученный фотохимически оксихлорофильный радикал может окислять комплексное соединение железа, которое в свою очередь способно к окислению воды через посредство деоксидазы. [35]
Поскольку потенциал водородного электрода также изменяется на величину - 2 3 RTJF на единицу рН, то потенциал кислородного электрода, измеренный относительно водородного электрода в том же растворе, всегда равен 1 229 в. Что касается зависимости от парциального давления кислорода, то для первых двух реакций при десятикратном изменении давления обратимый потенциал изменяется соответственно на 14 8 и 29 6 мв. [36]
Добавление к электролиту перекиси водорода ( рис. 2) в согласии с уравнением ( 7) смещает потенциал кислородного электрода в отрицательную сторону. [37]
 |
Снижение напряжения при электросинтезе перманганата. [38] |
Сложность реализации кислородной деполяризации в процессах электросинтеза органических соединений, протекающих без диафрагмы, определяется влиянием этих органических веществ на потенциал газодиффузионного кислородного электрода, который смещается в отрицательную сторону. [39]
Как показывает (4.21), увеличение Ю на единицу ( что означает уменьшение парциального давления кислорода на целый порядок) сопровождается уменьшением потенциала кислородного электрода на величину, близкую к 15 мв. [40]
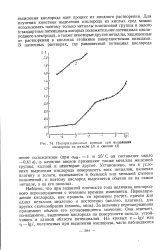 |
Поляризационные кривые при выделении кислорода на никеле ( / и свинце ( 2. [41] |
Для изучения кинетики выделения кислорода из кислых сред можно использовать поэтому только металлы платиновой группы и золото ( стандартные потенциалы которых положительнее потенциала кислородного электрода), а также некоторые другие металлы, защищенные от растворения в кислотах стойкими поверхностными окислами. [42]
Аноды из чистого никеля пассивируются в сульфатных растворах, свободных от хлоридов, уже при очень низких значениях анодной плотности тока, при этом анод принимает потенциал кислородного электрода. Ионы хлора в состоянии устранить пассивность, а потому технические никелевые электролиты должны наряду с сульфатом содержать также и ионы хлора для обеспечения анодной растворимости никеля. Особенное поведение никеля зависит от различной электронной структуры кристаллизующегося никеля и ионов никеля. [43]
Хотя коррозия стали в 18 % - ной H2SO4 протекает в основном за счет водородной деполяризации, при расчете степени контроля в качестве обратимого потенциала катодного процесса принят потенциал кислородного электрода, так как коррозионные испытания и, соответственно, измерения потенциалов проводили в атмосфере воздуха. [44]
С составляет - 0 076 в) и по характеру зависимости потенциала электрода от активности гидроксильных ионов. Величины потенциала кислородного электрода, полученные опытным путем, не совпадают поэтому с теоретическими. [45]
Страницы: 1 2 3 4