Потенциал - сурьмяный электрод
Cтраница 3
Для измерения рН неизвестного раствора сурьмяным электродом определяют потенциал сурьмяного электрода в этом растворе. Затем по калибровочной кривой находят, какому значению рН соответствует полученное значение потенциала. Поскольку сурьмяный электрод не вполне подчиняется уравнению Нернста, на калибровочном графике получится е прямая линия, а кривая и поэтому ответ будет тем точнее, чем ближе были взяты значения рН при построении калибровочной кривой. Но все же ответы будут не вполне точны. [31]
В первом нашем сообщении уже указывалось, что потенциал сурьмяного электрода при сильных сотрясениях изменяется, но в покое вновь быстро возвращается к прежней величине. Равным образом наблюдается сдвиг потенциала и при протекании измеряемой жидкости. Механическое перемешивание воды в термостате было допущено нами только после того, как мы убедились в том, что те незначительные сотрясения, которые вызываются работой мешалки, не сказываются заметным образом на величине потенциала сурьмяного электрода. [32]
Уравнение ( IX, 14) выражает зависимость потенциала сурьмяного электрода от концентрации водородных ионов раствора. [33]
Однако исследования показали, что не во всех кислых растворах потенциал сурьмяного электрода определяется ионами SbO, поэтому равновесный потенциал сурьмы будет соответственно изменяться. [34]
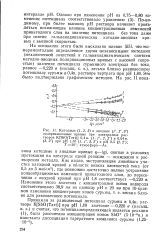
В интервале рН 3 7 - 5 5 ( рис. 9) потенциал сурьмяного электрода остается постоянным. Подобное постоянство потенциала в области рН от 5 0 до 7 0 наблюдал и Дони-Хе - нйльт [58], по мнению которого зависимость ф-р Н не является однозначной функцией в широком интервале рН вследствие изменения природы потенциалопределяющих - ионов. При более высоких рН, что возможно уже лишь в растворе буфера ( см. рис. 9), потенциал сурьмяного электрода вновь начинает изменяться. [35]
Объяснение этому явлению, как мы полагаем, следует искать в нарушении равновесия, обусловливающего потенциал сурьмяного электрода и вызываемого образованием комплексов со стороны трехокиси сурьмы с органическими кислотами. Это обстоятельство, разумеется, значительно ограничивает использование сурьмяного электрода и заставляет с большой осторожностью относиться к применению его в различных биологических средах. [36]
Этой точки зрения придерживаются Жуков и Авсеевич [19], которые считают, что подобная линейная зависимость достаточно хорошо описывает соотношение между потенциалом сурьмяного электрода и рН растворов. [37]
На основании пересечения катодных и анодных поляризационных кривых, полученных в растворах с различным рН ( рис. 45), были определены значения потенциалов сурьмяного электрода в активном состоянии. Как видно из рисунка, в растворе с рН 1 85 этот потенциал составляет 216 мв ( отн. При 10-кратном уменьшении концентрации ионов Н потенциал смещается в отрицательную сторону на 38 5 мв. [38]
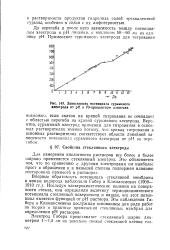 |
Зависимость потенциала сурьмяного электрода от рН в 70-процентном алкоголе. [39] |
Вероятно, сурьмяный электрод применим для титрования в основных растворителях именно потому, что кривая титрования в основных растворителях соответствует области линейной зависимости потенциала сурьмяного электрода от рН за перегибом. [40]
Авторы и сами говорят, что по своим качествам сурьмяные электроды несомненно ниже водородных, так как даже через 2 часа от начала измерения потенциал сурьмяных электродов отстоит от должного на 0 1 в переводе на рН и всегда смещается в кислую сторону, тогда как электродами предыдущих исследователей, как можно видеть из их работ, нужный потенциал достигался в течение 0 5 - 2 мин. [41]
Вычисленные значения потенциала сурьмяного электрода наносят на график, причем по оси абсцисс откладывается значение рН буферных растворов, а по оси ординат - соответствующее значение потенциалов сурьмяного электрода. [42]
Сурьмяным электродом нельзя пользоваться при наличии в растворе солей металлов, имеющих более положительный потенциал, чем сурьма, а именно в присутствии Bi, Pb, Sn и др. На потенциал сурьмяного электрода также оказывают влияние сульфитные щелочи, сероводород, перекись водорода, значительные концентрации хромовой, сернистой, марганцевой кислот и другие окислители и восстановители. [43]
На основании этого былю высказано мление [ 651, что экспериментально определенное двумя независимыми методами ( механической зачисткой и гальванодинами ческим ( снятием катодно-анодных поляризационных кривых с высокой скоростью) значение потенциала сурьмяного электрода без тока, равное - 0 220 в ( насыщ. Это было подтверждено графическим методом. [45]
Страницы: 1 2 3 4