Потенциал - цинковый электрод
Cтраница 1
Потенциал цинкового электрода в щелочном растворе, содержащем 300 - 600 г / л КОН, равен 1 25 В. При разряде такого электрода поляризация незначительна. Коррозия цинка происходит медленно из-за высокого перенапряжения выделения водорода. [1]
Потенциал цинкового электрода в щелочном электролите равен - 1 24 в, а потенциал кадмиевого электрода в растворах серной кислоты равен - 0 40 в. Оба значения указаны по отношению к нормальному водородному электроду. Данные электроды не отличаются высокой обратимостью, но удобны для практических измерений в условиях эксплуатации аккумуляторов. [2]
Потенциал цинкового электрода зависит от ионной концентрации цинка. [3]
Потенциал цинкового электрода отрицательнее потенциала водородного электрода, поэтому возможна коррозия цинка с выделением водорода. Однако благодаря высокому перенапряжению водорода скорость его выделения и соответственно скорость коррозии цинка невелики. Для увеличения перенапряжения водорода и соответственно снижения скорости коррозии цинка последний обычно амальгамируют. [4]
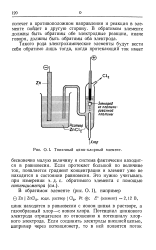 |
Типичный цинк-хлорный элемент. [5] |
Потенциал цинкового электрода отрицателен по отношению к потенциалу хлорного электрода. [6]
В этом случае потенциал цинкового электрода оказывается положительное потенциала двуокисномарганцевого электрода. В одиночном элементе переполюсовка никогда не происходит. [7]
Пусть необходимо определить потенциал цинкового электрода по водородной шкале. [8]
Как изменяется в процессе электролиза потенциал цинкового электрода, опущенного в сульфат цинка. [9]
На рис. 4 приведена схема измерения потенциала цинкового электрода относительно стандартного водородного электрода. [10]
С увеличением концентраций ОН - - ионов потенциал цинкового электрода сдвигается в отрицательную сторону, увеличиваясь по абсолютному значению. [11]
Таким образом, с уменьшением концентрации раствора потенциал цинкового электрода становится отрицательнее. [12]
Потенциал кадмиевого электрода примерно на 0 35 в положительнее потенциала цинкового электрода; по этой причине напряжение серебряно-кадмиевых аккумуляторов на такую же величину ниже напряжения серебряно-цинковых аккумуляторов. [13]
Можно показать ( доказательство здесь не приводится), что сдвиг потенциала цинкового электрода в отрицательную область понижает энергетический барьер для прямой реакции и одновременно повышает энергетический барьер для обратной реакции. Поэтому сдвиг потенциала цинкового катода в более отрицательную область по сравнению с его равновесным значением, когда суммарный ток равен нулю, способствует восстановлению цинка ( II) до металла и протеканию суммарного катодного тока. Сдвиг потенциала электрода, который приводит к протеканию некоторого суммарного тока ( в отсутствие какого-либо градиента концентраций) называется активационным сверхпотенциалом. Если неоходимо увеличить суммарный ток для восстановления цинка ( II) до металла, потенциал катода следует сдвинуть в значительной мере в отрицательную область, иначе говоря, чем больший ток требуется, тем большим должен быть активационный сверхпотенциал. [14]
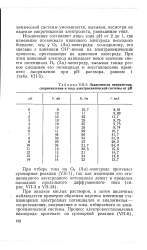 |
Зависимости напряжения, сопротивления и тока электрохимической системы от рН. [15] |
Страницы: 1 2 3