Потенциал - цинковый электрод
Cтраница 3
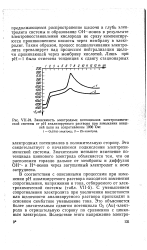 |
Зависимость электродных потенциалов электрохимической системы от рН анализируемого раствора при замыкании внешней цепи на сопротивление 1000 Ом. / - О2 ( Аи-электрод. 2 - Zn-электрод. [31] |
Это свидетельствует о начавшемся подкислении электрохимической системы. Значительно меньшее изменение потенциала цинкового электрода объясняется тем, что он расположен гораздо дальше от мембраны и диффузия ОН - - и Н - ИОНОБ через загущенный электролит к нему затруднена. [32]
Однако при протекании тока концентрация ионов цинка увеличивается, а концентрация ионов меди ( II) уменьшается. Это приводит к смещению потенциала цинкового электрода к менее отрицательным значениям, а потенциала медного электрода - к менее положительным. Суммарный эффект состоит в уменьшении потенциала элемента. В конце концов концентрации достигнут таких величин, при которых будет невозможен перенос электронов. [33]
Учитывая, что форма и ход потенциальных кривых серебряного электрода в СК - и СЦ-аккумуляторах аналогичны, а омические потери напряжения и поляризации кадмиевого и цинкового электродов примерно одинаковы, рассчитайте отдачу по энергии у СК-аккумулятора, использовав данные задачи 82 для СЦ-аккумулятора. Равновесный потенциал кадмиевого электрода примерно на 0 42 В положительнее потенциала порошкового цинкового электрода. [34]
Учитывая, что форма и ход потенциальных кривых серебряного электрода примерно одинаковы в СК - и СЦ-аккуму-ляторах, а омические потери напряжения и поляризации кадмиевого и цинкового электродов мало отличаются по численной величине, рассчитать отдачу по энергии у СК-ак-кумуляторов, использовав данные задачи 80 для СЦ-акку-муляторов. Равновесный потенциал кадмиевого электрода примерно на 0 42 В выше потенциала порошкового цинкового электрода. [35]
Из уравнения ( 48) следует, что по мере увеличения концентрации ионов водорода и уменьшения концентрации нашатыря отрицательный потенциал цинкового электрода становится более положительным. Таким образом, уменьшение рН раствора является отрицательным фактором, снижающим потенциал цинкового электрода. [36]
В этом элементе самопроизвольный химический процесс: Zn CuSO4 - - Си ZnSO4 осуществляется по электрохимическому механизму. Окисление цинка Zn - Zn2 2е протекает в одном электроде ( полуэлементе), восстановление меди Си2 2е - Си - в другом, медном, имеющем положительный потенциал по сравнению с потенциалом цинкового электрода. [37]
В этом элементе самопроизвольный химический процесс: Zn CuSO4 - - Си ZnSO4 осуществляется по электрохимическому механизму. Окисление цинка Zn - Zn2 2е протекает в одном электроде ( полуэлементе), восстановление меди Си2 2е - Си - в другом, медном, имеющем положительный потенциал по сравнению с потенциалом цинкового электрода. [38]
Цинковые электроды, покрытые сплошным слоем гидрата окиси цинка, не могут разряжаться. Если элемент с таким электродом находится в батарее, то при разряде вместо растворения цинка на нем начинается выделение кислорода из воды, имеющейся в растворе. При выделении кислорода происходит значительный сдвиг потенциала цинкового электрода в положительную сторону. При этом потенциал цинкового электрода оказывается положительнее потенциала двуокисномарганцевого электрода. Так происходит изменение полярности, то есть переполю-совка элемента в батарее при образовании сплошной пленки гидрата окиси цинка на поверхности электрода. В одиночном элементе переполюсовка никогда не происходит. [39]
Цинковые электроды, покрытые сплошным слоем гидрата окиси цинка, не могут разряжаться. Если элемент с таким электродом находится в батарее, то при разряде вместо растворения цинка на нем начинается выделение кислорода из воды, имеющейся в растворе. При выделении кислорода происходит значительный сдвиг потенциала цинкового электрода в положительную сторону. При этом потенциал цинкового электрода оказывается положительнее потенциала двуокисномарганцевого электрода. Так происходит изменение полярности, то есть переполю-совка элемента в батарее при образовании сплошной пленки гидрата окиси цинка на поверхности электрода. В одиночном элементе переполюсовка никогда не происходит. [40]
В качестве такого нулевого электрода сравнения берется так называемый нормальный водородный электрод. Измеренная разность потенциалов между нормальным водородным электродом и каким-либо другим электродом характеризует величину потенциала данного электрода относительно потенциала нормального водородного электрода. Так как потенциал нормального водородного электрода условно принят за 0, потенциал цинкового электрода относительно водородного будет равен - 0 76 в. [41]
Цинк растворяется более активно, чем серебро, поэтому накапливающиеся на цинковом электроде электроны могут перемещаться на серебряный электрод. Для этого необходимо соединить, оба металла проводником. Переходящие в раствор ионы Zn2 должны быть нейтрализованы эквивалентным количеством анионов, диффузионно проникающих из электролита, окружающего серебряный электрод. Напряжение на электродах равно 1 56 В ( при концентрациях ионов Zn2 и Ag по 1 г-ион / л), а величина - 1 56 В и есть потенциал цинкового электрода относительно серебряного. Знак минус показывает, что в указанной цепи электроны во внешней цепи текут от измеряемого электрода к электроду сравнения. [42]
Цинк растворяется более активно, чем серебро, поэтому накапливающиеся на цинковом электроде электроны могут перемещаться на серебряный электрод. Для этого необходимо соединить оба металла проводником. Переходящие в раствор ионы Zn2 должны быть нейтрализованы эквивалентным количеством анионов, диффузионно проникающих из электролита, окружающего серебряный электрод. Напряжение на электродах равно 1 56 В ( при концентрациях ионов Zn2 и Ag по 1 г-ион / л), а величина - 1 56 В и есть потенциал цинкового электрода относительно серебряного. Знак минус показывает, что в указанной цепи электроны во внешней цепи текут от измеряемого электрода к электроду сравнения. [43]
Таким образом, электродным потенциалом в водородной шкале является напряжение электрохимической системы, в которой левым электродом является водородный электрод при стандартных условиях. Например, при замыкании электрохимической системы, представленной последней схемой, во внешней цепи электроны потекут справа налево. Поэтому, согласно условию, принятому при определении знаков напряжения электрохимических систем ( см. 2.1), напряжение такой системы отрицательно. Следовательно, и потенциал цинкового электрода в водородной шкале отрицателен. [44]
Страницы: 1 2 3