Стандартный потенциал - система
Cтраница 1
Стандартный потенциал системы V2H2 / H равен - 2 23 В. Следовательно, ион Н - - один из самых сильных восстановителей. [1]
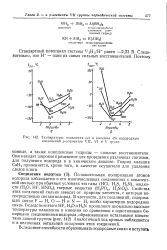 |
Температуры плавления ( а и кипения ( б водородных соединений р-элементов VII, VI и V групп. [2] |
Стандартный потенциал системы V2H2 / H - равен - 2 23 В. Следовательно, ион Н - - один из самых сильных восстановителей. [3]
Стандартный потенциал системы / Нз / Н равен - 2 23 в. Следовательно, ион Н - - один из самых сильных восстановителей. Поэтому ионные, а также комплексные гидриды - сильные восстановители. Они находят широкое применение для проведения различных синтезов, для получения водорода и в химическом анализе. Гидрид кальция СаН2 применяется, кроме того, в качестве осушителя для удаления следов влаги. [4]
Стандартный потенциал системы ( Ag е - Ag) равен 0 8 В. Однако в 1 М растворе хлороводородной кислоты он снижается до 0 22 В, Это вызвано тем, что концентрация ионов серебра из-за образования осадка AgCl снижается и определяется уже произведением растворимости последнего. В данном случае значение этого потенциала может быть найдено простым расчетом, подобно тому, как это было сделано ранее при оценке направления реакции между ионами водорода и металлической ртутью в растворе иодово-дородной кислоты. [5]
Стандартный потенциал системы Cus / Cw равен 0 17 В, а - системы Ь / 21 - - 0 54 В. Сравнивая стандартные потенциалы, приходим к выводу, что иод является более сильным окислителем, чем медь ( II); следовательно, реакция (21.20) должна проходить справа налево, а не наоборот, как наблюдается в действительности. [6]
ЕО - стандартный потенциал системы, а индекс s указывает на приэлектродные концентрации компонентов. [7]
ЕМ - стандартный потенциал системы, образующей левый полуэлемент элемента (7.35), a aHg - активность ртути в насыщенной амальгаме, отнесенная к активности чистой ртути. [8]
Установлено [21], что стандартный потенциал системы галлий - галлат равен - 1 326 в ( отн. [9]
В зависимости от разности стандартных потенциалов систем Ox / Red и Ox / Red в хронопотенциометрии проявляются одно переходное время или два, подобно тому как наблюдаются один или два пика на хроновольтамперометрических кривых. [10]
Я ( Н р - стандартный потенциал системы в неводном растворителе относительно и. [11]
Джонс и Колвин [8] определили стандартный потенциал системы Y ( v) / V () при температуре 25 С и 0 С для реакции, равный соответственно 0 337 и 0 361 В. Реальный потенциал системы УШМПП по данный В.С.Сырокомского и В.В.Авилова [9] равен 0 359 0 02 В, что удовлетворительно совпадает с результатами Джонса и Колвина. [12]
Оценки показывают, что если абсолютное значение стандартного потенциала системы Н / Н2 в водных растворах составляет - 4 59 В, то в жидком аммиаке соответствующая величина равна - 3 9 В, а для уксусной кислоты - 4 9 В. [13]
Окислительно-восстановительная реакция самопроизвольно протекает в растворе, если стандартный потенциал системы, включающей окислитель этой реакции, больше стандартного потенциала системы, включающей восстановитель реакции. [14]
Серебро ( II) известно как один из сильнейших окислителей, стандартный потенциал системы Agn / Ag в растворе азотной кислоты равен 1 70 В. В водном растворе Ag неустойчиво, поэтому его не используют как раствор титранта. Для снижения влияния диспропорционирования серебра ( II) на выход по току титранта необходимо, чтобы концентрация вспомогательного реагента Ag1 в растворе была не менее 0 1 М при - 10 С, в качестве рабочего электрода используется золотой анод. Конечную точку титрования определяют потенциометрически или биамперометрически. Индикаторный серебряный электрод предварительно обрабатывают электрохимически или химически раствором Ag11 в азотной кислоте. [15]
Страницы: 1 2 3