Стандартный потенциал - система
Cтраница 2
Определение вольфрама ( VI) по методу окисления - восстановления затруднено невысоким стандартным потенциалом системы WVI / WV. Поэтому для амперометрического определения приходится прибегать к очень сильным восстановителям, например к хрому ( II) [ И ], что связано с определенными неудобствами вследствие того, что растворы хрома ( II) неустойчивы при хранении. [16]
Маркуса вытекает, что скорость окислительно-восстановительных реакций с внешнесферным механизмом увеличивается с увеличением разности стандартных потенциалов систем, участвующих в реакции. [17]
Равновесные концентрации веществ, участвующих в реакции, определяются константой равновесия реакции, рассчитанной по стандартным потенциалам систем ( 1) и ( 2) Гсм. [18]
Окислительно-восстановительная реакция самопроизвольно протекает в растворе, если стандартный потенциал системы, включающей окислитель этой реакции, больше стандартного потенциала системы, включающей восстановитель реакции. [19]
Как уже отмечалось, для того чтобы во всех этих случаях наблюдались два пика, необходимо, чтобы стандартный потенциал системы Ox / Red был значительно отрицательнее стандартного потенциала первой системы. Влияние скорости развертки напряжения поляризации на величину токов первого и второго пиков при различных степенях их обратимости показано на рис. 15.2. Кривые / - 4 соответствуют четырем рассмотренным случаям. [20]
А и В - коэффициенты, представляющие стандартные потенциалы и -, поделенные на Л Т, иначе говоря, эти коэффициенты характеризуют изменение стандартного потенциала системы в процессе реакции. [21]
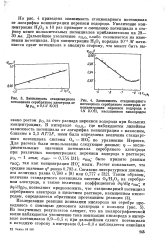 |
Зависимость стационарного. [22] |
В интервале Сн2о2, где наблюдается линейная зависимость потенциала от логарифма концентрации с наклоном, близким к 2 3 RT / 2F, нами была определена величина стандартного потенциала системы 02 - Н02 по уравнению Нернста. [23]
Стандартный потенциал данной индикаторной системы точно неизвестен, но опыты показали, что в не слишком кислых растворах резкое изменение окраски от бесцветной к фиолетовой ( с возможной промежуточной зеленой окраской) протекает при потенциале примерно 0 75 в. Стандартный потенциал системы Fe, F равен 0 78, а системы Сг2О7 - -, Сг в кислой среде примерно 1 2 в. Таким образом, пригодный для данного титрования окислительно-восстановительный индикатор должен иметь стандартный потенциал около 0 95 в. Отсюда можно заключить, что дифениламин должен быть мало пригодным при титровании двухвалентного железа бихроматом в кислом растворе. Это действительно так и есть при титровании простых солей двухвалентного железа. На практике при титровании к раствору прибавляют фосфорную кислоту или раствор фторида; эти вещества образу1от с ионами трехвалентного железа комплексные ионы, что ведет к тому, что эффективный стандартный потенциал системы двух - трехвалентное железо снижается примерно до 0 5 в. Изменение потенциала при конечной точке титрования в таком случае будет примерно 0 6 - 1 1 в, а следовательно, дифениламин, изменяющий свою окраску вблизи Д75 в, оказывается удовлетворительным индикатором. [24]
При измерении стандартных потенциалов этих систем необходимо, чтобы активность ионов водорода была равна единице; значения стандартных потенциалов трех приведенных выше систем равны 1 52, 1 33 и 1 52 в соответственно. Стандартный потенциал системы ChjVaClg равен 1 36 в, так что из этих трех окислителей только бихромат-ион может существовать в растворе НС1, тогда как перманганат - и бромат-ионы будут окислять анионы хлора. [25]
В зависимости от условий она может протекать в прямом или обратном направлениях. Иод представляет собой окислитель средней силы: стандартный потенциал системы равен 0 54 В. Поэтому сильные восстановители легко окисляются свободным иодом. [26]
Изменение потенциала в процессе титрования описывается простой логарифмической функцией. При т 2 потенциал системы становится равным стандартному потенциалу системы титрующего реагента Е о. При т 1 ветви кривой титрования систем титруемого вещества и титрующего реагента сливаются. Скачок на кривой титрования позволяет найти точку эквивалентности. [27]
Штрелов [10-11] предположил наличие небольших отклонений от постоянства ЕКЬ для четырех растворителей. Основной его вклад - предположение о том, что стандартные потенциалы систем: ферроцен - феррицин ( бициклопентадиенилжелезо) и кобальто-цен - кобалтицин ( бициклопентадиенилкобальт) практически: постоянны в различных растворителях благодаря большим радиусам ионов и тому факту, что в этих ионах заряд расположен: между двумя слоями, как в сэндвиче. [28]
Эти константы описывают скорость электродного процесса при потенциале электрода, равном нулю относительно нормального водородного электрода. Сравнениетаких констант для разных электродных процессов действительно не позволяет сопоставить кинетику этих процессов, так как стандартные потенциалы сравниваемых систем различаются между собой. [29]
По окончании титрования, определив величину потенциала электрода сравнения относительно водородного нуля, наносят данные титрования на график и графически определяют эквивалентную точку. Зная объем раствора Се ( SO4) 2, пошедший на титрование, по участку кривой до эквивалентной точки проводят вычисление стандартного потенциала системы хинон-гидрохинон. Проводят определение величины стандартного потенциала в 6 - 8 точках кривой и из полученных значений находят среднее. [30]
Страницы: 1 2 3