Измеренный потенциал
Cтраница 1
Измеренный потенциал ( например, 0 010 В) может соответствовать любой из двух неизвестных концентраций, так что концентрационные цепи могут давать неоднозначные для интерпретации результаты. Этого можно избежать, если тщательно соблюдать знаки электродов в стандартном и неизвестном растворах. [1]
Измеренный потенциал будет отрицательнее, чем равновесный для данного электрода, и на таком электроде будет постоянно протекать восстановление окисленной формы. [2]
Измеренные потенциалы, которые ниже, чем идеальные потенциалы, показывают, что идеальный элемент реакции неадекватно описывает реальную ситуацию. Отклонения от идеальности обусловлены переносом воды и ( или) коаниона. [3]
Измеренные потенциалы хорошо совпадали с вычисленными из концентраций водородного иона, определенных с обеих сторон мембраны с помощью водородного электрода. [4]
Чтобы измеренный потенциал имел определенный смысл, измерения следует производить относительно устойчивого электрода сравнения. Электрод сравнения представляет собой электрохимический полуэлемент, помещенный непосредственно в исследуемый раствор или в специальный сосуд, который имеет электролитический контакт с исследуемым раствором. Выбор редокс-пар для приготовления электродов сравнения ограничен. Пара должна быть обратимой, устойчивой и неактивной по отношению ко всем компонентам системы, в которой она используется. Пары ртуть - ртуть ( I) и серебро - серебро ( I) применяют очень часто, поскольку перенос электрона в обоих случаях происходит очень быстро. [5]
Если измеренный потенциал находится в области потенциалов пассивности, то исследуемая сталь стойка к МКК. [6]
 |
Поляризационные защитные потенциалы. [7] |
Если измеренные потенциалы находятся в указанных в таблице пределах, то КЛ может считаться защищенной от коррозии. Обычно КЛбез электрической защиты от коррозии не имеют минимального защитного потенциала, и коррозионные процессы могут привести к местным повреждениям брони и оболочек кабелей и стальных трубопроводов ли ний высокого давления. [8]
Сумма измеренных потенциалов обоих электродов электролитической ячейки равна напряжению на ячейке за вычетом омического падения напряжения в растворе. [9]
Если же измеренных потенциалов больше двух, то, в случае адекватности модели клетки С2, оценки k по уравнению ( 13) для любых отношений разноточечных потенциалов должны давать одинаковые величины X. ХИ-задача для плоской клетки разрешима при использовании 3-точечной схемы микроэлектродных измерений. [10]
Все величины измеренных потенциалов сталей приводятся по водородной шкале с учетом. [11]
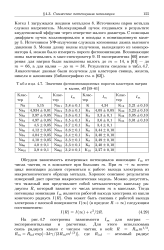 |
Значения фотоионизационных порогов кластеров натрия. [12] |
Обсудим зависимость измеренных потенциалов ионизации / т от числа частиц га в комплексе при больших га. При га - оо потенциал ионизации должен стремиться к работе выхода электрона из макроскопического образца металла. Хорошее описание результатов измерений дает простая макроскопическая модель. Можно допустить, что тяжелый ион представляет собой металлическую капельку радиусом Я, который зависит от числа атомов га в капельке. [13]
Так как всякий измеренный потенциал ( например, 0 010 в, как указано выше) может соответствовать одной из двух неизвестных концентраций ( 0 1500 М или 0 0680 М в приведенном примере), возникает некоторая неопределенность. Ее легко избежать, если учесть, что меньшая концентрация отвечает более положительному из двух электродов. [14]
Страницы: 1 2 3 4
