Измеренный потенциал
Cтраница 4
 |
Изменение скорости коррозии во времени на неактивировэнном ( 3 и активированном ( 1, 2, 5 железе без защитной пленки и под полиэтиленовой. [46] |
Исследования также показали, что при наличии на поверхности металла активатора первичная активация железа при отсутствии защитной пленки протекает значительно быстрее ( вследствие гигроскопичности соли), и первоначально измеренный потенциал лежит в области максимально возможной активации. [47]
Затем замыкают рубильники 10, с помощью движковых реостатов 12 устанавливают в цепи ток 10 ма, измеряют потенциометром 6 потенциал стального электрода и записывают в табл. 15 значение измеренного потенциала и соответствующее ему показание миллиамперметра. [48]
 |
Применение идеальных поляризационных кривых для расчета скорости коррозии и определения соотношения площадей катодной и анодной фаз корродирующего металла. [49] |
Если кривые ( Ук) обР и ( а) обр М на рис. 183 - это кривые катодной и соответственно анодной поляризации материалов катодной и анодной фаз металла, а измеренный потенциал корродирующего гетерогенного металла равен Vx, то точки пересечения горизонтали, проведенной на уровне этого потенциала V, с катодной и анодной поляризационными кривыми дают плотности тока на катодной t K и анодной ta фазах. [50]
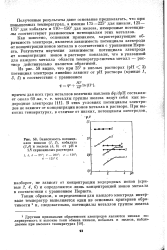 |
Зависимость потенциалов никеля ( 1, 2, кобальта ( 3 4 и железа ( 5, б от рН в IN сернокислых растворах. [51] |
Полученные результаты дают основание предполагать, что при повышенных температурах, а именно 175 - 225 для никеля, 125 - 175 для кобальта и 110 - 150 для железа, измеренные потенциалы соответствуют равновесным потенциалам этих металлов. [52]
Таким образом, член С в уравнении ( 7 - 23) представляет собой от1, и если ( E0 - - Ej) известно, то концентрация а свободных анионов может быть вычислена из измеренного потенциала. Функция п ( а) для комплексов ионов металлов с Хг - легко получается с помощью уравнений ( 7 - 53) и ( 3 - 4), и отсюда можно вычислить константы устойчивости. Однако хлорид-ные и бромидные комплексы цинка [198], кадмия [177], таллия ( III) [26, 170] и железа ( III) [18] были изучены с помощью элементов типа ( 7 - 52) с хлор-серебряными электродами. [53]
 |
Измерение потенциала ка - [ IMAGE ] Измерение тока в оболочке. [54] |
Если измерять потенциал на контуре защитного заземления ТП с присоединенными к нему свинцовыми оболочками кабелей по отношению к искусственному заземлителю, забитому на расстоянии 5 - 10 м от контура заземления, и сравнивать результаты с измерениями непосредственно на оболочках кабелей, то величины измеренных потенциалов практически идентичны. Это дает возможность отказаться от шурфов и вскрытия мостовых и ограничиться измерениями в ТП, не выводя из работы его оборудования. Лишь в случаях резких колебаний потенциалов возникает необходимость в промежуточных измерениях со вскрытием шурфов. [55]
Я не буду подробно останавливаться на вопросе о введении величины работы выхода электрона из металла в соотношения, выражающие зависимость постоянной а от природы металла, освещенном в статьях с М. И. Темкиным; ограничусь указанием на то, что работы выхода электрона ив металлов в объем раствора при одинаковых измеренных потенциалах этих металлов, в отличие от работ выхода в вакуум, должны быть равны. [56]
 |
Ячейка для одновременного снятия катодной и анодной поляризационных кривых. [57] |
Каждая плотность тока сохраняется постоянной в течение 15 - 20 мин и затем измеряется потенциал катода и анода. Измеренные потенциалы пересчитывают относительно нормального водородного электрода и строят кривые катодной и анодной поляризаций. Эти кривые являются кривыми прямого хода. При достижении плотности тока в 1 ма / см2 начинают уменьшать плотность тока и вновь измеряют потенциалы. Получают поляризационные кривые обратного хода. [58]
Для приготовления 0 1 М раствора растворяют 11 1 г KI в 50 мл воды, прибавляют раствор 7 1 г КЮ3 в 250 мл воды и сразу же прибавляют 200 мл концентрированной соляной кислоты ( не содержащей Fe111 и G12); затем раствор разбавляют до объема 1000 мл. Измеренный потенциал этого раствора должен быть равен 0 75 - 0 8 мв относительно насыщенного каломельного электрода. Если потенциал окажется более низким, то прибавляют по каплям 0 1 М раствор КЮ3 до наступления заметного скачка потенциала; если потенциал окажется слишком высоким, то прибавляют несколько капель 0 1 М раствора KI до заметного уменьшения потенциала, затем добавляют по каплям раствор КЮ3 до достижения указанного выше потенциала. Приготовление раствора IC1 можно контролировать визуально при помощи хлороформа. Если хлороформ при встряхивании раствора окрашивается в фиолетовый цвет, то прибавляют по каплям раствор КЮ3 до его обесцвечивания. Если же хлороформ не окрашен, то прибавляют раствор KI до появления фиолетовой окраски, а затем раствор КЮ3 до ее исчезновения. [59]
Страницы: 1 2 3 4