Измеренный потенциал
Cтраница 2
На рис. 11.8 представлены измеренные потенциалы при пробном пуске в сравнении с потенциалом при свободной коррозии. Если в каждой точке будет соблюдаться неравенство UeinUs, то плотность защитного тока может считаться достигнутой. Согласно имеющемуся опыту можно принять, что в ходе эксплуатации будет достигнуто и соотношение Uaus. Это следует определять при последующем проверочном измерении; причем может потребоваться и корректировка плотности защитного тока. [16]
Эквивалентную точку находят по графику зависимости измеренного потенциала от добавленного количества раствора калия гидроокись по ГОСТ 24363 - 80 или по записи потенциометриче-ского титрования. [17]
Далее во всех опытах на основании измеренного потенциала Ag / AgHal-электрода в присутствии HNO3 и ионов висмута ( которые связывают часть ионов галоида в комплекс) по калибровочной кривой рассчитывалась концентрация свободных ионов галоида. Некоторая условность значения этой величины не имеет существенного значения для обсуждения результатов, так как концентрация ионов галоида в сериях опытов изменялась довольно мало. [18]
Катодное смещение потенциала должно производиться относительно некоторого измеренного потенциала, установившегося на трубопроводе в отсутствие всякого катодного воздействия со стороны. [19]
В данном случае вычисление потенциала U по измеренному потенциалу U несколько громоздко, зато в нем не содержится нетермодинамических представлений. [20]
В данном случае вычисление потенциала V по измеренному потенциалу U несколько громоздко, зато в нем не содержится нетермодинамических представлений. [21]
С этой оговоркой мы можем сказать, что измеренные потенциалы соответствуют вычисленным малым концентрациям ионов. [22]
На основании полученных результатов пишут выводы о природе измеренных потенциалов ( являются они обратимыми или необратимыми), указывают контролирующий фактор коррозии железа в исследованных растворах. [23]
Навстречу индикаторному электроду измерительной ячейки включают потенциал, соответствующий предварительно измеренному потенциалу точки эквивалентности, и титруют раствор до тех пор, пока разность потенциалов станет равной нулю. [24]
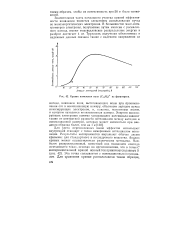 |
Кривая появления иона ( С12Н8 из фенантрена. [25] |
Для учета перечисленных выше эффектов используют внутренний стандарт с точно измеренным потенциалом ионизации. Результаты экспериментов выражают обычно двумя кривыми: для стандартного и исследуемого вещества. Анализ кривых может осуществляться различными методами. Эта точка связывается с ионизационным потенциалом. [26]
Линейная зависимость между Е и рН позволяет рассчитывать рН раствора по измеренному потенциалу хингидронного электрода. [27]
Проведенные при подготовке к набору модели расчеты позволяют определить коэффициент соответствия между измеренным потенциалом узлов модели и векторным потенциалом точек поля. [28]
Если анализируемый газ в данной электрохимической системе является потенциалопределяющим веществом, то по измеренному потенциалу индикаторного электрода можно вычислить с помощью уравнения ( 1 - 6) активность данного газа. [29]
В этом случае равновесие между системой в растворе и электродом будет устанавливаться медленно и измеренный потенциал может оказаться ошибочным. Такой посредник представляет собой вещество, подвергающееся обратимому окислению - восстановлению и быстро приходящее в равновесие с электродом. [30]
Страницы: 1 2 3 4