Стационарный потенциал
Cтраница 1
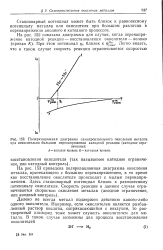 |
Поляризационная диаграмма самопроизвольного окисления металла при относительно большом перенапряжении катодной реакции ( катодное ограничение. Л - анодная кривая. К, - катодная кривая. [1] |
Стационарный потенциал может быть близок к равновесному потенциалу металла или окислителя при большом различии в перенапряжении анодного и катодного процессов. [2]
Стационарный потенциал равен 1600 мВ относительно медно-сульфатного электрода. [3]
 |
Поляризационные кривые в водном растворе, насыщенном сероводородом, для алюминиевого покрытия. [4] |
Стационарный потенциал по сравнению со сталью без покрытия смещается с - 0 7 В до - 0 32 В. Эффективно тормозится как анодный, так и катодный процесс. При статическом нагру-жении, создающем в образцах растягивающее напряжение, равное 1 1 ат, наблюдается некоторое смещение потенциала в отрицательную область, облегчение анодного и катодного процессов, но и в этом случае обеспечивается эффективная защита стали. [5]
Стационарный потенциал, в отличие от равновесного, характеризуется протеканием на одном и том же электроде двух или более реакций, которые носят название сопряженных. [6]
Стационарный потенциал в таких условиях может, как и равновесный, не зависеть от перемешивания. Если установление стационарного потенциала связано с реакцией восстановления кислорода, обусловленной медленностью его доставки к электроду, то при перемешивании раствора потенциал смещается в положительную сторону. [7]
 |
Зависимость скоростей реакций разряда и ионизации водо. [8] |
Стационарный потенциал определяется взаимным расположением поляризационных кривых парциальных процессов. Так как скорости отдельных процессов зависят от состояния поверхности электрода, то Ес также является функцией состояния поверхности металла в отличие от равновесного потенциала. Равновесный потенциал водородного электрода не зависит от природы металла. [9]
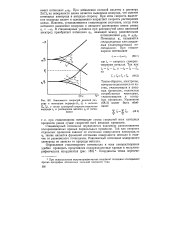 |
Зависимость скоростей реакций раз-ряда и ионизации водорода ( 1Ь Г и металла ( 2, ( 2, а также суммарной скорости выделения водорода / х и растворения металла ( 2 от потенциала. [10] |
Стационарный потенциал определяется взаимным расположением поляризационных кривых парциальных процессов. Так как скорости отдельных процессов зависят от состояния поверхности электродадо Фс также является функцией состояния поверхности металла в отличие от равновесного потенциала. Равновесный потенциал водородного электрода не зависит от природы металла. [11]
 |
Зависимость скоростей реакций разряда и ионизации водо. [12] |
Стационарный потенциал определяется взаимным расположением поляризационных кривых парциальных процессов. Так как скорости отдельных процессов зависят от состояния поверхности электрода, то Ес также является функцией состояния поверхности металла в отличие от равновесного потенциала. Равновесный потенциал водородного электрода не зависит от природы металла. [13]
Стационарный потенциал для процесса Pd Pd2 2G равен 0 987 в. Палладий не тускнеет и не окисляется на воздухе. [14]
Стационарный потенциал для процесса Pd tPd2 2 Q равен 0 987 В. Палладий не тускнеет и не окисляется на воздухе. Палладий стоек в горячей НС1, но в присутствии кислорода значительно растворяется. Палладий растворяется при комнатной температуре в царской водке. В кислотах ( хлорной, соляной, бромистоводородной при 100 С), а также в растворах FeCl3, CuClz, NaCIO палладий неустойчив. Хлор, бром сухой и влажный при комнатной температуре растворяют палладий. В уксусной кислоте ( ледяной), в растворах НдС1г, CuSCu, A12 ( 80) 3 при 100 С палладий устойчив. В сероводороде ( влажном), иоде ( сухом) при комнатной температуре палладий также устойчив. [15]
Страницы: 1 2 3 4 5