Стационарный потенциал
Cтраница 3
Стационарные потенциалы гидразинового и кислородного электродов были рассмотрены ранее, поэтому остановимся лишь на взаимодействии гидразина и кислорода. Так как кислород мало растворим в растворах электролитов, то взаимодействием его с гидразином на аноде можно в первом приближении пренебречь. [31]
Стационарные потенциалы и потенциалы выделения цинка на катоде имеют более отрицательные значения ( см. рис. IV-1, кривая 4), чем в кислых электролитах. Повышенная катодная поляризуемость и снижение выхода цинка по току при увеличении плотности тока в этих электролитах обусловливают более равномерное распределение металла по катодной поверхности. Качество осадков в большой степени за: висит также от рН, концентрации свободного пирофос-фата калия или натрия и температуры. [32]
Стационарный потенциал феррита в атом растворе составляет 0 05 В. [33]
Стационарный потенциал магния примерно на один вольт оказывается положительное его нормального потенциала. В нейтральных или слабощелочных электролитах сдвиг потенциала магниевого электрода в область более положительных значений зависит от наличия на его поверхности сплошной пленки, способствующей замедлению анодной реакции. Поэтому потенциал магниевого анода в водных электролитах зависит прежде всего от солевого состава и в меньшей степени от концентрации собственных ионов, которые и определяют стационарный потенциал магниевого электрода. Вещества, способствующие снятию окисной пленки или увеличивающие ее проницаемость, как правило, облегчают течение анодной реакции и сдвигают потенциал в область более отрицательных значений. Наоборот, вещества, создающие защитную пленку, тормозят анодную реакцию и сдвигают потенциал магниевого электрода в область более положительных значений. Первый случай наблюдается при наличии в среде ионов хлора СПи серной кислоты S0 - -, способных легко проникать через пленку; второй случай - в щелочных средах или в присутствии ионов, образующих нерастворимые соединения магния. [34]
Стационарный потенциал покрытия с увеличением содержания кремния смещается в положительную сторону. При этом степень катодного контроля снижается с ростом содержания кремния. Алюминиевое покрытие с содержанием кремния характеризуется значительной областью анодной пассивности. Меньший интервал пассивности наблюдается у покрытий из чистого алюминия и с добавкой 0 1 % кремния. Все покрытия характеризуются незначительной величиной коррозионного тока в пассивном состоянии. [35]
Стационарный потенциал покрытия с увеличением содержания кремния смещается в положительную сторону. При этом степень катодного контроля снижается с ростом содержания кремния. Алюминиевое покрытие с содержанием кремния характеризуется значительной областью анодной пассивности. Меньший интервал пассивности наблюдается для покрытия из чистого алюминия и с добавкой 0 1 % кремния. Все покрытия характеризуются незначительной величиной коррозионного тока в пассивном состоянии. Степень катодного контроля снижается с ростом содержания кремния. Присутствие ионов хлора в сероводородсо-держащей среде препятствует возникновению пассивности, однако степень анодного и катодного контроля достаточна для обеспечения высокой коррозионной стойкости. При этом повышение содержания кремния, как и в отсутствие хлора, способствует облагораживанию стационарного потенциала. [36]
Стационарный потенциал хрома при непрерывной зачистке поверхности под раствором или в результате непосредственного активирования поверхности катодной поляризацией, а также при коррозии с выделением водорода в неокислительных кислотах может иметь заметно отрицательный потенциал, приближающийся к значениям равновесного потенциала. В обычных же условиях стационарный потенциал хрома гораздо положительнее равновесного и очень сильно зависит от соотношений пассивирующих и активирующих факторов в растворе. [37]
Стационарный потенциал 6-фазы колеблется в пределах 0 40 - 0 45 в. Интенсивное окисление Мо02 начинается при ф я 0 45 в ( что соответствует началу анодного активирования металлического молибдена) и сопровождается экспоненциальным увеличением скорости растворения с образованием МоО - и одновременным окислением до окислов более высокой валентности. [38]
 |
Стационарные потенциалы электродов в растворе Ш N2H4 6 M КОН при 20 С. [39] |
Стационарные потенциалы различных электродов в растворе гидразина существенно отличаются друг от друга. [40]
Стационарный потенциал кислородного электрода обычно отрицательнее значения равновесного потенциала. Разница между значениями этих потенциалов составляет 0 1 - 0 4 В. Трудности достижения равновесного потенциала могут быть обусловлены протеканием наряду с восстановлением кислорода до воды и других процессов: окисление примесей и восстановление кислорода до пероксида водорода. [41]
Стационарный потенциал неизолированной трубы ( патрона на переходе газопровода через железную или шоссейную дорогу), покрытой плотным слоем ржавчины, более положителен, чем потенциал очищенной трубы. [42]
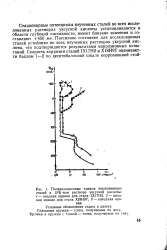 |
Поляризационные кривые нержавеющих сталей в 15 % - ном растворе уксусной кислоты. / - анодная кривая для стали 1Х17Н2. 2 - анодная кривая для стали XI8H9T. 3 - катодная кривая. [43] |
Стационарные потенциалы изученных сталей во всех исследованных растворах уксусной кислоты устанавливаются в области глубокой пассивности, имеют близкие значения и составляют 450 же. Пассивное состояние для исследованных сталей устойчиво во всех изученных растворах уксусной кислоты, что подтверждается результатами коррозионных испытаний. [44]
Стационарный потенциал капельного электрода определяется реакцией растворения металла, содержащегося в ртути, и реакцией выделения водорода. Но так же, как и в случае обычного растворения металла, при стационарном потенциале наблюдается одностороннее течение электрохимического процесса при отсутствии внешнего тока. [45]
Страницы: 1 2 3 4 5