Стационарный потенциал - сплав
Cтраница 2
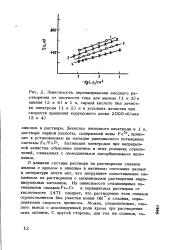
Приведенная на рис. 63 анодная потенциостатическая кривая для титана показывает, что в растворе серной кислоты в атмосфере водорода, а тем более в атмосфере кислорода, стационарные потенциалы сплавов титана с платиной и палладием находятся в области пассивных значений. Весовые измерения коррозионной стойкости образцов ( табл. 7) подтверждают самопроизвольную пассивируе-мость катодно-легированного титана в этих условиях не только в кислородной, но также и в водородной атмосфере. [16]
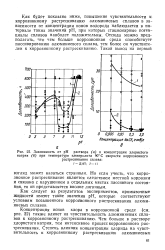 |
Зависимость от рН раствора ( а и концентрации хлористого. [17] |
Как будет показано ниже, повышение чувствительности к: коррозионному растрескиванию алюминиевых сплавов в зависимости от концентрации ионов водорода наблюдается в интервале таких значений рН, при которых стационарные потенциалы сплавов наиболее положительны. Отсюда можно предполагать, что чем больше коррозионная среда способствует пассивированию алюминиевого сплава, тем более он чувствителен к коррозионному растрескиванию. [18]
Интерметаллические соединения, выделяющиеся в процессе далеко зашедшего распада твердого раствора, могут оказывать неблагоприятное влияние на коррозионную стойкость либо вследствие изменения стационарного потенциала сплава, либо за счет больших скоростей собственного растворения выделений при стационарном потенциале сплава. [19]
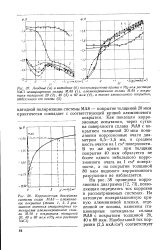
Катодная кривая для сплава лежит на 0 35 - 0 40 в положительнее катодной кривой для титана вледствие значительного снижения перенапряжения водорода из-за наличия в сплаве палладия. Стационарный потенциал сплава поэтому находится в области значений потенциалов, где титан полностью запассиви-рован. На анодной кривой для сплава отсутствует участок анодного растворения. Для выяснения причин повышения устойчивости двойного сплава титан-палладий при дополнительном легировании хромом и молибденом была исследована анодная поляризация титана и сплавов. Для 80 % - ной H2SO4 результаты представлены на фиг. [20]
Pt - Из фигуры видно, что вследствие сильного снижения перенапряжения выделения водорода на сплаве катодные кривые сплава лежат на 0 35 - 0 4 в положительнее кривой для титана. Стационарный потенциал сплава вследствие этого сильно смещается в положительную сторону. В 40 % - ной H2SO4 такой сдвиг приводит к тому, что потенциал попадает в область значений, где титан полностью пассивирован. [21]
При исследовании поляризации сплавов титана с платиной и палладием в соляной кислоте получены аналогичные кривые с приведенными на фиг. Стационарные потенциалы сплавов вследствие снижения перенапряжения водорода оказываются сильно сдвинутыми в положительную сторону по сравнению со стационарным потенциалом титана, так, что, например, в соляной кислоте до 20 % - ной концентрации потенциалы сплавов оказываются в области устойчивого пассивного состояния. [22]
В то же время стационарные потенциалы сплавов титана с платиной и палладием приближаются к потенциалу платины. Стационарные потенциалы сплавов титана с платиной или палладием в атмосфере водорода практически совпадают со стационарным потенциалом платины в этих условиях. [23]
О влиянии состава раствора на растворение сплавов железа с хромом и никелем в активном состоянии данных в литературе почти нет, что затрудняет сопоставление механизма их растворения с механизмами растворения индивидуальных металлов. Из зависимости стационарных потенциалов сплавов Fe-С г в сернокислых растворах от кислотности [47] следует, что растворение этих сплавов осуществляется без участия ионов ОН - в стадиях, определяющих скорость процесса. [25]
Таким образом, стационарный потенциал сплава определяется диффузией компонентов не только в жидкой солевой среде, но и в твердой металлической фазе. Дать какое-либо общее количественное выражение стационарных потенциалов сплавов поэтому не представляется возможным. [26]
В предыдущей работе было показано, что легирование титана палладием не оказывает непосредственного влияния на анодный процесс ионизации титана. Коррозия сплава могла быть рассчитана, если известны стационарный потенциал сплава и кривая анодной поляризации чистого титана в данных условиях. Поэтому величина скорости коррозии тройных сплавов Ti-Pd-Mo и Ti - Pd-Cr можно также определить, если замерить стационарный потенциал тройного сплава и определить плотность тока анодного растворения двойного сплава Ti-Mo ( Сг) при этом значении потенциала. [27]
На рис. 38 приведена коррозионная диаграмма [72, 73], позволяющая определить ток коррозии в рассматриваемых системах. На катодную поляризационную кривую алюминиевой пленки, отделенной от основы, нанесены стационарные потенциалы сплава МА8 с покрытием толщиной 20, 40 и 80 мкм. [29]
Гетерогенные сплавы в электропроводных агрессивных средах при стационарных условиях следует рассматривать практически как полностью поляризованные системы. Скорость коррозии отдельных участков гетерогенных сплавов в этом случае определяется не столько различием в потенциалах структурных составляющих, сколько различием в плотностях анодного тока на различных участках металла, что определяется величиной стационарного потенциала сплава при коррозии в электролитах пли величиной наложенного анодного потенциала при анодном растворении сплавов. [30]
Страницы: 1 2 3