Наименьший потенциал - ионизация
Cтраница 1
Наименьшие потенциалы ионизации у s - элементов I группы и наибольшие у р-элементов VIII группы. [1]
 |
Схема строения свободной дуги. [2] |
Наименьшими потенциалами ионизации обладают щелочноземельные металлы ( калий, кальций) и их соединения. Вещества, обладающие малыми потенциалами ионизации, вводят в состав электродных покрытий, порошков для устойчивого горения дуги. При их присутствии в межэлектродном пространстве возрастает число электрически заряженных частиц при постоянном значении затраченной энергии. [3]
 |
Схема строения сварочной душ. [4] |
Наименьшими потенциалами ионизации обладают щелочноземельные металлы ( калий, кальций) и их соединения. [5]
Из приведенных радикалов наименьший потенциал ионизации имеет mpem - бутнл. Это является следствием возможности большего рассредоточивания - ( - - заряда углеродного атома в катионе, образующемся в результате отрыва электрона, если водородные атомы замещены метильными группами. [6]
Как видно, наименьшим потенциалом ионизации обладают калий, натрий, барий, литий, алюминий, кальций и др. Поэтому для повышения устойчивости горения электрической дуги эти вещества вводят в зону дуги в виде электродных покрытий или флюсов. [7]
 |
Типичная зависимость сечения ионизации от энергии электронов. [8] |
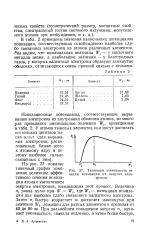
В табл. 2 приведены значения наименьших потенциалов ионизации, соответствующих освобождению наиболее слабо связанных электронов из атомов различных элементов. Мы видим, что минимальная величина Wt - у щелочного металла цезия, а наибольшие значения - у благородных газов, у которых валентные электроны образуют замкнутые оболочки, отличающиеся очень прочной связью с атомами. [9]
В табл. 1 даны значения наименьших потенциалов ионизации для некоторых наиболее часто встречающихся при сварке элементов периодической системы. [10]
Из таблицы следует, что наименьшим потенциалом ионизации обладают элементы щелочной группы. Поэтому материалы, содержащие эти элементы, вносят в покрытия для устойчивого горения дуги. [11]
Из металлов, указанных в этой таблице, алюминий имеет наименьший потенциал ионизации, поэтому по сравнению с другими элементами легче отдает Зр-электрон, в то время, как два Ss-элек-трона атома алюминия не принимают участия в образовании соединений пониженной валентности. Энергия образования низковалентных соединений металла значительно меньше энергии образования, соединений обычной валентности. Поэтому получить низковалентные соединения, подобные A1F, CaCl, SiO и др., в обычных условиях не представляется возможным. [12]
В табл. 1 даны значения атомного радиуса, потенциалов, возбуждения, наименьших потенциалов ионизации и работы выхода для некоторых наиболее часто встречающихся при сварке элементов периодической системы, а также энергия сродства к электрону. [13]
Из всех стабильных щелочных элементов рубидий и цезий имеют наибольший атомный радиус и соответственно наименьший потенциал ионизации ( см. табл. 2, стр. [14]
В сильно неравновесной плазме тлеющего разряда электронная температура в основном определяется атомами с наименьшим потенциалом ионизации. Поэтому примеси, линии которых начинаются с высоких энергетических уровней, в обычных условиях не возбуждаются, если основной компонент имеет малую энергию ионизации. Хорошо известным примером этого является свечение ртутно-аргоновых ламп, излучающих в основном спектр ртути даже тогда, когда парциальное давление аргона выше давления паров ртути. [15]
Страницы: 1 2 3