Ионный потенциал
Cтраница 3
Если определить ионный потенциал ср, как отношение заряда катиона к его радиусу в кристалле, то можно утверждать, что вообще устойчивость комплексов с небольшими или высоко заряженными ионными лигандами и полидентатными лигандами увеличивается по мере возрастания ионного потенциала. [31]
Электросродство и ионный потенциал бериллия и магния отличаются от тех же величин щелочноземельных металлов. Растворимость сульфатов и хрома-тов щелочноземельных металлов позволяет их разделять и обнаруживать при совместном присутствии. [32]
По величине ионных потенциалов рассматриваемые катионы разбиваются на две подгруппы. Близким величинам потенциалов соответствует и сходство химико-аналитических свойств. Катионы Ве2, А13, Ti4 и Сг3 имеют законченные 2 - и 8-элект-ронные слои. Как правило, они не образуют труднорастворимых сульфидов. [33]
По значению ионных потенциалов катионы второй руппы стоят между первой и третьей аналитическими руппами и во многих отношениях являются переход -: ымя между этими группами. Так, с одной стороны, юдобно катионам первой группы они образуют легко астворимые, сравнительно сильные основания. С другой - ак же, как и катионы третьей группы, образуют трудно раство-шмые карбонаты и фосфаты. [34]
Влияние величины ионного потенциала не проявляется, однако, столь отчетливо при рассмотрении одинаково заряженных ионов элементов - ближайших соседей плутония по актинидному ряду. Увеличение порядкового номера в ряду U-Np-Pu и связанное с этим уменьшение радиусов ионов не приводит, как правило, к столь значительному повышению прочности комплексных соединений, которое позволило бы на этой основе построить методы разделения этих элементов, находящихся в одном валентном состоянии. [35]
 |
Разделение третьей аналитической группы на подгруппы. [36] |
Катионы с ионными потенциалами IT 4 6 до 8 6 образуют гидроокиси амфотерного характера. [37]
Катионы с низкими ионными потенциалами образуют сульфиды, которые не растворимы в сульфиде аммония и едких щелочах. Катионы с высокими ионными потенциалами образуют тиоангидриды - соединения, растворимые в сульфиде аммония и едких щелочах. [38]
Катионы с умеренным ионным потенциалом в водной среде гидролизуются так, что при нейтрализации основанием образующейся в результате гидролиза кислоты получаются нерастворимые гидроксиды. [39]
При близких величинах ионного потенциала наибольшими значениями Н характеризуются d - и / - элементы. Коэффициент а передает способность к депрото-нированию свободного лигаида в водном растворе. Большую кислотность, как правило, обнаруживают в комплексах лиганды с большей склонностью к депротонированию в свободном состоянии. [40]
На основании различия ионных потенциалов Na, Са2 и Li попытайтесь предсказать, какой из хлоридов, NaCl, СаС12 или LiCl, имеет наименьшую степень ионного характера. [41]
Здесь приводится значение эффективного ионного потенциала ( см. стр. [42]
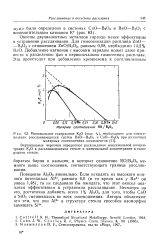 |
Минимальное содержание К2О ( мол. %, необходимое для гомогенизации расслаивающихся систем ВаО - В2О3 и СаО - В2О3 при различных. [43] |
Если исходить из высокого ионного потенциала А13, равного 6 0 ( в то время как у Ва2 он равен 1 48), то не следовало бы ожидать, что этот окисел окажется эффективным в устранении расслаивания. Несмотря на это, достаточно добавить всего 1 % А12О3 для того, чтобы СаО и SiO2 смешивались во всех соотношениях. [44]
 |
Вид образцов для определения прочности сцепления цементов с металлами. [45] |
Страницы: 1 2 3 4