Ионный потенциал
Cтраница 4
По мере уменьшения ионного потенциала катиона наблюдается ускорение процесса взаимодействия окисла с фосфорной кислотой, и наоборот, по мере увеличения ионного потенциала имеет место замедление процесса. В соответствии с этим в одних случаях проявление вяжущих свойств наблюдается только при нагревании до 100 - 400, в других случаях вяжущие свойства проявляются уже при комнатной температуре, в некоторых случаях взаимодействие протекает настолько интенсивно, что нарушается процесс нормального структурообразования и для обеспечения нормального процесса твердения необходимо предварительно обжечь окисел. [46]
Ионы Zr4 с максимально высоким ионным потенциалом испытывают ярко выраженную тенденцию к комплексо-образованию с ионами гидроксила. Эти гидроксокомплексы Zr4, как уже отмечалось, должны быть весьма устойчивыми в растворах разбавленных кислот. Более подробно Комплексообразование с ионами ОН ранее рассматривалось в связи с процессами гидролиза и образования полимерных соединений. [47]
Ион Li по значению ионного потенциала занимает промежу-очное положение между катионами первой и второй групп: это казывается на его аналитиче-ких свойствах. С одной сторо -: ы, он образует аналогично ио -: ам щелочных металлов сравнительно легко растворимое ильное основание, трудно рас-воримый цинкуранилацетат iZn ( UO2b ( CH3COO) 9 ( анало -: ш с Na), а с другой стороны, отличие от катионов первой руппы выделяется, подобно канонам второй группы, в виде рудно растворимых фосфатов, арбонатов и фторидов. [48]
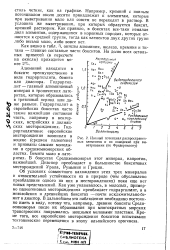 |
Ионный потенциал распространен-эоцене ( среднем палеогене ных элементов и их поведение при вы - И признаны самыми МОЛОДЫ - ветривании ( по Фредериксону. [49] |
Например, кремний с ионным потенциалом около десяти принадлежит к элементам, которые при выветривании мало или совсем не переходят в раствор. В условиях же выветривания, при которых образуется боксит, кремний растворим. Как правило, в бокситах все-таки немалая доля элементов, содержащихся в коренных породах, которые относятся к средней группе, тогда как элементов двух других групп либо весьма мало, либо вовсе нет. [50]
 |
Классификация катионов в зависимости от числа электронов во внешней оболочке ( п и ионного потенциала ( z / r, где г измеряется в А. [51] |
Катионы группы В с более низкими ионными потенциалами и оболочками из 18 электронов, легко поляризующиеся и образующие комплексы, устойчивость которых часто превышает устойчивость комплексов металлов группы А. [52]
 |
Значения ионных потенциалов и характер гидроокисей. [53] |
Нельзя, однако, рассматривать ионные потенциалы как едш ственный фактор, влияющий на растворимость гидроокисей. Tai при увеличении поляризующей способности катиона криста лическая Структура гидроокисей изменяется и переходит в боле устойчивую, чем и обусловливается значительное уменьшени растворимости последних. [54]
Ясно, что, чем больше ионный потенциал М, тем больше окружающие кислород электроны смещены по направлению к иону металла. Кислород в свою очередь оттягивает электроны связей О - Н от атомов водорода. [55]
С ростом степени окисления увеличивается ионный потенциал элемента Э и преобладает диссоциация по кислотному типу с отщеплением иона водорода, так как связь Э - О упрочняется, а за счет перераспределения электронной плотности у кислорода связь 0 - Н ослабевает. При сравнимой прочности связей 0 - Н и Э - - О диссоциация гидрок-сида может одновременно протекать и по I, и по II типам с отщеплением как ионов водорода, так и гидроксид-ионов. [56]
Страницы: 1 2 3 4