Фазовый потенциал
Cтраница 1
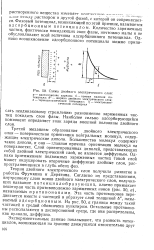 |
Схема двойного электрического слоя. [1] |
Фазовый потенциал, возникающий по этой причине, называется адсорбционным потенциалом. Количество заряженных частиц, фактически покидающих свои фазы, ничтожно малы и не обусловливают всей величины адсорбционного потенциала. [2]
Простейший случай таких фазовых потенциалов на границе между твердым электродом и раствором электролита, в который - он опущен, мы уже рассмотрели подробно. [3]
Диссоциация ионита сопровождается преодолением ионами фазового потенциала. Однако сумма работ по преодолений) фазового потенциала ионами, выходящими из ионита и входящими в него 2Ф2 равна нулю. Сам потенциал ф на границе набухшего геля и растворителя, вероятно, очень невелик. [4]
Диссоциация ионита сопровождается преодолением ионами фазового потенциала. Однако сумма работ по преодолению фазового потенциала ионами, выходящими и входящими из ионита StpzF, равна нулю. Сам потенциал ф на границе набухшего геля и растворителя, вероятно, очень невелик. [5]
В более узком смысле под фазовыми потенциалами понимают, обычно те скачки потенциала, которые возникают на границе между двумя несмешивающимися растворами электролитов. Их не следует смешивать с диффузионными потенциалами, которые были выше рассмотрены. [6]
Таким образом, говоря о фазовых потенциалах, следует иметь в виду лишь контактную разность потенциалов Вольты, Vя - - V. В этих случаях мы имеем полное право считать, что, каково бы ни было соотношение между электростатическими и химическими силами, оно будет одинаково для обеих фаз, так что разность внутренних потенциалов или гальваническая разность потенциалов будет равна контактной разности потенциалов Вольты. [7]
При застывании расплавов в виде стекол фазовые потенциалы и межфазное натяжение на границе расплав - кристаллическая фаза велики. Для наших объектов межфазное натяжение больше всего в присутствии Si021 резко падает при замене Si02 на А1203 и еще больше при замене на MgO и СаО; наименьшее межфазное натяжение обусловливается присутствием NaaO. С повышением температуры оно возрастает. [8]
В качестве неизвестных переменных в первой принимаются фазовые потенциалы или давления, а во второй - насыщенность и давление в одной из фаз. [9]
Менее понятно, однако, почему повышение фазового потенциала перенапряжение) содействует удалению адсорбционого слоя водородных атомов. Как показал Гарней1, энергия адсорбции зависит значительной мере от свободных электронов в металле, так как ix приближение к атомным ядрам адсорбированного водорода сильно 1лияет на энергию адсорбции. [10]
Это уравнение не исключает возможности того, что фазовый потенциал тс может быть равным нулю, что и принимается некоторыми. Докажем, что в общем случае такая возможность исключена. [11]
Существует, впрочем, два других механизма образования фазовых потенциалов и двойных электрических слоев, причем двойной слой в этих случаях обычно расположен главным образом по одну сторону от фазовой границы. Один из этих механизмов заключается в том, что ни положительные, ни отрицательные компоненты не могут покидать свои фазы в сколько-нибудь значительных количествах, но частицы одного знака стремятся адсорбироваться на поверхности раздела в большем количестве, чем частицы другого знака. [12]
Диссоциация ионита - выделение ионов сопровождается преодолением ионами фазового потенциала. К этому следует добавить, что и сам потенциал ср на границе набухшего геля и растворителя, вероятно, очень невелик. [13]
Кроме того, оставаясь на позициях теории Гун, трудно понять смысл разницы в понятиях термодинамического фазового потенциала и электрокинетического потенциала. [14]
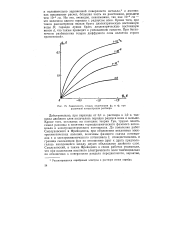 |
Зависимость между величинами г з0 и различной концентрации раствора. [15] |
Страницы: 1 2 3