Равновесный потенциал - реакция
Cтраница 1
Равновесный потенциал реакции 2Н 2е Н2 при Рн 1 ат и рН4 равен ( уравнение 3 в табл. IV) рр - 0 059 4 - 0 236 в. [1]
Высокое значение равновесного потенциала реакции ( XIV10) показывает, что образование атомарного кислорода в присутствии ионов кислоты возможно лишь в том случае, если такие анионы окисляются с большим перенапряжением. Можно, по-видимому, заключить, что вода а аноде окисляется с образованием молекулярного [ реакция ( XIV, 8) ], а не атомарного [ реакция ( XIV, 10) ] кислорода. [2]
Высокое значение равновесного потенциала реакции ( 4) показывает, что образование атомарного кислорода по уравнению ( 4) в присутствии ионов SOj возможно лишь в том случае, если разряд последних происходит с большим перенапряжением. Правда, можно допустить, что ионы SO, окисляясь атомарным кислородом до КнОй, настолько понижают концентрацию О, что образование его становится возможным и при более низких потенциалах. Однако такое же деполяризующее действие оказывает и процесс молизации атомарного кислорода, как это видно из сравнения значений Е О и.и. Какой из процессов - окисление ли ионов SO. [3]
 |
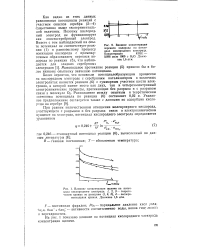
Поляризационные кривые для реакции выделения водорода на различных металлах из кислых растворов. [4] |
В щелочных растворах равновесный потенциал водородной реакции и реальные потенциалы выделения водорода ( с учетом поляризации) сдвинуты в отрицательную сторону. В связи с этим изучение этой реакции затруднено: на многих электродах наряду с выделением водорода возможен разряд катионов раствора и внедрение образующихся атомов металла в кристаллическую решетку электродного материала ( см. разд. За счет энергии образования сплава этот процесс происходит при потенциалах, более положительных равновесного потенциала данного металла, поэтому вклад этой реакции в общий ток при катодной поляризации может быть большим. В области средних значений рН во избежание заметного изменения кислотности раствора из-за расходования ионов гидроксония или образования ионов гидроксила используют буферные растворы. [5]
Необходимо учесть, что равновесные потенциалы реакций 1 и 2 ( табл. 22) приведены Для активности, равной единице. [6]
Как видно из этих данных равновесные потенциалы реакций с участием окислов серебра ( 2 - 4) существенно выше экспериментальной величины. Поэтому кислородный электрод не функционирует как окисносеребряный электрод. [8]
 |
Поляризационные кривые, иллюстрирующие принцип независимости протекания электродных реакций. [9] |
Величина P отвечает при этом равновесному потенциалу реакции (18.1), a ff - равновесному потенциалу реакции (18.2), причем ЯГр1 положительнее 8 Р2) - Согласно ПСПК. [10]
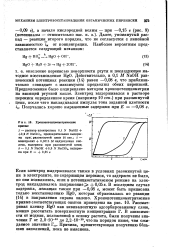 |
Хронопотеициометрическис кривые. [11] |
Действительно, в 0 1 М NaOH равновесный потенциал реакции ( 14) равен - 0 08 в, что приблизительно совпадает с максимумом предволны обеих перекисей. Предположение было подкреплено методом хронопотенциометрии на висящей ртутной капле. [12]
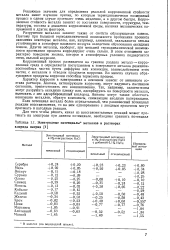 |
Электродные потенциалы металлов в растворах хлорида натрия. [13] |
Если потенциал металла более отрицательный, чем равновесный потенциал реакции восстановления, то на нем одновременно с анодным процессом могут протекать и катодные реакции. [14]
 |
Возникновение скачков потенциала на границе металл - электролит. [15] |
Страницы: 1 2 3 4