Равновесный потенциал - реакция
Cтраница 2
Если потенциал металла более отрицателен, чем равновесный потенциал реакции восстановления, то на нем одновременно с анодным процессом может протекать и катодный. Простой расчет показывает, что на большинстве металлов, наряду с процессом анодного растворения, представляющим собой окислительную реакцию, сопровождающуюся накоплением в металле электронов, могут протекать и восстановительные реакции, сопровождающиеся отнятием от электрода восстанавливающимися частицами электронов. [16]
Потенциал анода, однако, стабилизируется на уровне равновесного потенциала реакции окисления воды, поскольку этот реагент всегда в изобилии присутствует на поверхности электрода. Следовательно, поскольку уменьшились IR и перенапряжение, потенциал катода должен стать более отрицательным. Таким образом, вследствие поляризации потенциал электрода становится более отрицательным. [18]
 |
Равновесные потенциалы реакций. [19] |
Для определения потенциалобразующего процесса на кислородном электроде были рассчитаны равновесные потенциалы реакций с образованием и без образования перекиси водорода, а так же для фазовых окислов серебра. [20]
Величина P отвечает при этом равновесному потенциалу реакции (18.1), a ff - равновесному потенциалу реакции (18.2), причем ЯГр1 положительнее 8 Р2) - Согласно ПСПК. [21]
Совместный разряд катионов Mz и Н3О ( или Н2О) становится возможным, если равновесный потенциал реакции (V.42) мЕр более отрицательный, чем равновесный потенциал реакции (V.43) н ер, или же если мер олее положительный, чем н2Ер, но металл выделяется с большим перенапряжением. [22]
Совместный разряд катионов Мг и Н3О ( или Н2О) становится возможным, если равновесный потенциал реакции (V.42) мбр более отрицательный, чем равновесный потенциал реакции (V.43) н вр, или же если мер олее положительный, чем нгер, но металл выделяется с большим перенапряжением. [23]
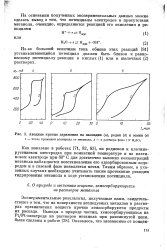 |
Анодные кривые заряжения на палладии ( а, родии ( б и осмии ( в. [24] |
Из-за большой величины тока обмена этих реакций [81] устанавливающийся потенциал должен быть близок к равновесному потенциалу реакции в кислых ( 1) или в щелочных ( 2) растворах. [25]
При этом оказалось, что потенциал, при котором наблюдалось увеличение скорости газовыделения, близок к равновесному потенциалу реакции восстановления магнетита по уравнению ( 1) и, соответственно, к потенциалу активации железного электрода. Характерно, что в области химического растворения магнетита ( 0 6 - 0 9 в) скорость растворения и газовыделения для обоих электродов одного порядка. [26]
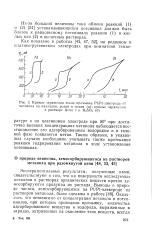 |
Кривые заряжения после промывки Pt / Pt-электрода от. [27] |
Из-за большой величины тока обмена реакций ( 1) и ( 2) [51] устанавливающийся потенциал должен быть близок к равновесному потенциалу реакции ( 1) в кислых или ( 2) в щелочных растворах. [28]
Совместный разряд катионов Mz и Н3О ( или Н2О) становится возможным, если равновесный потенциал реакции (V.42) мЕр более отрицательный, чем равновесный потенциал реакции (V.43) н ер, или же если мер олее положительный, чем н2Ер, но металл выделяется с большим перенапряжением. [29]
Совместный разряд катионов Мг и Н3О ( или Н2О) становится возможным, если равновесный потенциал реакции (V.42) мбр более отрицательный, чем равновесный потенциал реакции (V.43) н вр, или же если мер олее положительный, чем нгер, но металл выделяется с большим перенапряжением. [30]
Страницы: 1 2 3 4