Равновесный потенциал - реакция
Cтраница 3
Из этого выражения видно, что в случае чисто концентрационной поляризации потенциал полуволны определяется только индивидуальными характеристиками вещества, разряжающегося на катоде ( равновесным потенциалом реакции и коэффициентами конвективной диффузии разряжающихся частиц в растворе и ртути), и не зависит от концентрации его, а также и других, посторонних, веществ в растворе. [31]
Равновесный потенциал реакции восстановления ионов гидроксония смещается на 0 059В в электроотрицательную сторону при повышении рН на единицу при 25 С. [32]
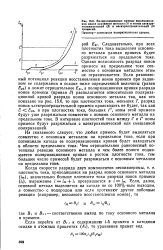 |
Поляризационные кривые восстановления ионов основного металла ( Я и ионов электроположительной ( 2 и электроотрицательной ( 3 примесей. Пунктир-суммарная поляризационная кривая. [33] |
Из сказанного следует, что любая примесь будет выделяться совместно с основным металлом на предельном токе, если при потенциале катода ее поляризационная кривая будет находиться в области предельного тока. Чем отрицательнее равновесный потенциал реакции основного металла и чем более полого поднимается поляризационная кривая с ростом плотности тока, тем большее число примесей будет разряжаться с основным металлом на предельном токе. [34]
При анодной и катодной поляризации электрода аналогично равновесному изменяется и компромиссный потенциал. В этом случае отклонение электродного потенциала от значений равновесных потенциалов приводимых реакций называется не перенапряжением, а поляризацией г фп - фкп, где фп - потенциал поляризации. Поляризация, как и перенапряжение, есть функция плотности тока i. Если при одновременном течении нескольких электродных реакций ток обмена одной реакции значительно выше тока обмена другой, то компромиссный потенциал приближается к равновесному потенциалу более быстрой электродной реакции. [35]
Физико-химические свойства и особенно тип электрической проводимости оксидов определяют их электрохимическое поведение в растворах. Восстановление оксидов происходит при потенциалах более отрицательных, чем равновесный потенциал реакции восстановления оксида в данном растворе. [36]
Один из обычных примеров такого эффекта приведен на рис. К. С увеличением глубины концентрация кислорода в воде уменьшается и на определенном расстоянии от ватерлинии в каком-то месте конструкции будет достигнут равновесный потенциал реакции восстановления кислорода. Как следствие этого, поверхность металла, находящаяся ближе к ватерлинии, ведет себя как катод, а в некоторых точках поверхности, удаленных от ватерлинии, происходит растворение металла. [37]
Сравнение равновесных потенциалов некоторых металлов ( Cd, Cu, Ag), рассчитанных термодинамически, показывает хорошее совпадение с измеренными на практике. Однако потенциалы многих металлов, опущенных в растворы своих ионов, значительно отличаются от равновесных потенциалов, рассчитанных термодинамически; к таким металлам относится и железо. Причина этого несоответствия состоит в том, что при измерениях часто устанавливается не равновесный потенциал реакции Ме - - - - Ме е, а потенциал других процессов или систем. [38]
Сравнение равновесных потенциалов некоторых металлов ( Cd, Cu, Ag), рассчитанных термодинамически, показывает хорошее совпадение с измеренными на практике. Однако потенциалы многих металлов, опущенных в растворы своих ионов, значительно отличаются от равновесных потенциалов, рассчитанных термодинамически; к таким металлам относится и железо. Причина этого несоответствия состоит в том, что при измерениях часто устанавливается не равновесный потенциал реакции Me - - - Ме е, а потенциал других процессов или систем. [39]
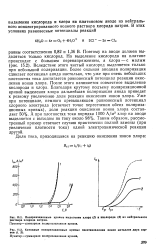 |
Поляризационные кривые выделения хлора ( / и кислорода ( 2 из нейтрального раствора хлорида натрия.| Катодные поляризационные кривые восстановления ионов металлов двух сортов ( /, 2. [40] |
Поэтому на аноде должен выделяться только кислород. Вследствие этого чистый кислород выделяется только при небольшой поляризации. Более сильная анодная поляризация сдвигает потенциал анода настолько, что уже при очень небольших плотностях тока достигается равновесный потенциал реакции окисления ионов хлора. После этого начинается совместное выделение кислорода и хлора. [41]
Равновесный потенциал водородного электрода устанавливается на электродах из платинированной платины и из других дисперсных металлов платиновой группы как в кислых, так и в щелочных растворах. В щелочных растворах он устанавливается также на электродах из дисперсного никеля, а в кислых - из дисперсного карбида вольфрама WC. Все эти электроды чувствительны к загрязнениям - уже при небольшой концентрации адсорбирующихся примесей они теряют свою активность, и их бестоковый потенциал больше не соответствует равновесному потенциалу водородной реакции. Электроды из неплатиновых металлов, кроме того, чувствительны к окислительным воздействиям. На других металлах водородный потенциал не устанавливается из-за низкого значения тока обмена водорода, а также вследствие искажающего влияния процесса саморастворения, которому подвержены многие металлы ( в частности, железо) в области равновесного водородного потенциала. [42]
Ток обмена при разряде ионов Мп2, однако, довольно значителен, и осаждение марганца сопровождается сравнительно небольшой поляризацией. В то же время перенапряжение выделения водорода на марганце велико. Это дает возможность вести катодное выделение марганца совместно с водородом при доста - точно высоком рН электролита. При этом равновесный потенциал реакции выделения водорода сдвигается примерно на 0 5 В в отрицательную сторону и резко снижается ее ток обмена. Поэтому уже небольшое подщелачивание электролита в прикатодном пространстве, вызванное выделением водорода, должно привести к выпадению гидроокиси. [43]
В пределах точности имеющихся данных о термодинамическом потенциале образования СгО3 ( от - 218 до - 221 ккал / моль [28]) стандартный потенциал реакции ( 6а) почти совпадает со стандартным потенциалом реакции ( 6), близким к 1 17 в. Поэтому в растворах с рН порядка О соотношение скоростей реакций ( 6а) и ( 6) должно определяться в основном факторами, могущими различно влиять на их видимые кинетические сопротивления. Этим, возможно, и объясняется тот факт, что в кислых электролитах одни авторы [52] на участке перепассивации наблюдали растворение хрома и в трех - и в шестивалентном состоянии, а другие [53] - только в шестивалентном. С повышением рН относительная вероятность растворения по схеме ( 6а) должна снижаться ( так как равновесный потенциал реакции ( 6) становится менее положительным); наоборот, в очень концентрированных растворах сильных кислот можно ожидать ее существенного повышения. [44]
Чтобы на электродах протекал процесс с заданной скоростью, требуется определенное количество электрической энергии на каждую стадию. На первой стадии оно пропорционально концентрационной составляющей перенапряжения или концентрационной поляризации, которая с энергетической стороны объясняется следующим. Равновесные потенциалы вычисляют, исходя из средней активности ( концентрации) реагирующих веществ в растворе. У электродов они или срабатываются или нарабатываются, поэтому там их активность отличается от средней. Равновесный потенциал реакции, вычисленный по значению истинной активности веществ у электродов, отличается от потенциала, вычисленного по средней активности. Разность между ними составляет концентрационную поляризацию. Она пропорциональна работе концентрирования или разбавления растворов от среднего значения активности до истинного, которое создается у электродов, и тем больше, чем выше скорость реакции на электродах. [45]
Страницы: 1 2 3 4