Изотермический потенциал
Cтраница 3
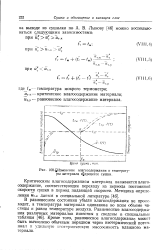 |
Изменение влагосодержания и температуры материала в процессе сушки. [31] |
В равновесном состоянии убыли влагосодержания не происходит, а температура материала одинакова во всем объеме частицы и равна температуре воздуха. Кроме того, равновесное влагосодержание может быть вычислено обычным порядком через изотермический потенциал и удельную изотермическую массоемкость влажного материала. [32]
Термодинамическими потенциалами являются следующие функции состояния системы, посредством которых выражают термодинамические свойства системы: внутренняя энергия, энтальпия, свободная энергия ( или изохорный потенциал) и изобарный потенциал. Нередко термин термодинамический потенциал применяют и в более узком смысле, обозначая им изохорный и изобарный изотермические потенциалы или даже только изобарный потенциал. [33]
Что касается условия термического равновесия, то, как упоминалось, его нельзя получить, пользуясь критерием равновесия с изотермическим потенциалом F: равенство температур обеих фаз системы служило исходной предпосылкой при формулировке задачи. [34]
Явление пересыщения было установлено ( 17951 впервые Т. Е. Ловицем, который открыл существование пересыщенных растворов и изучал их. Возможность существования их связана сзатрудне-ниямив возникновении зародышей новой фазы, так как очень малый ( в первый момент) размер выделяющихся частичек новой фазы увеличивает изотермические потенциалы вещества и делает эти частички менее устойчивыми. С этим же в большей или меньшей степени связана и сохраняемость метастабильных кристаллических фаз и стеклообразного состояния. [35]
Явление пересыщения было установлено ( 1795) впервые Т. Е. Ловицем, который открыл существование пересыщенных растворов и изучал их. Возможность существования их связана с затруднениями в возникновении зародышей новой фазы, так как очень малый ( в первый момент) размер выделяющихся частичек новой фазы увеличивает изотермические потенциалы вещества и делает эти частички менее устойчивыми. С этим же в большей или меньшей степени связана и сохраняемость метаста-бильных кристаллических фаз и стеклообразного состояния. [36]
Явление пересыщения было установлено ( 1795) впервые Т. Е. Ловицем, который открыл существование пересыщенных растворов и изучал их. Возможность существования их связана с затруднениями в возникновении зародышей новой фа з ы, так как очень малый ( в первый момент) размер выделяющихся частичек новой фазы увеличивает изотермические потенциалы вещества и делает эти частички менее устойчивыми. С этим же в большей или меньшей степени связана и сохраняемость метастабильных кристаллических фаз и стеклообразного состояния. [37]
Работа таких гальванических элементов ( см. табл. 85) служит наиболее ярким свидетельством неправильности принципа Бертло. Здесь работа со-всршается - g вронссс яротскаст еаменрвнэтедшв, MeeM & rfat - на-эидотермячнаеть - химической реакции, так как направление самопроизвольного течения процесса определяется не тепловым эффектом его, а в данном случае уменьшением соответствующего изотермического потенциала. [38]
В предыдущей главе были даны общие уравнения, использование которых открывает широкие возможности расчета многих производственных процессов. Теперь следует познакомиться с тем, как эти уравнения применяются при практических расчетах. При расчетах изотермических потенциалов оказалось целесообразным расчленить задачу, на две части: 1) определить изменение потенциала ( а следовательно, и константу равновесия) в данной реакции для каких-то условий, принятых за стандартные, и 2) пересчитать полученные значения для интересующих нас условий. [39]
Полезно сопоставить эти три диаграммы. Следует отметить, в частности, что изотермический обратимый фазовый переход не вызывает изменения обоих изотермических потенциалов, в то время как значения энтальпии Нт и энтропии ST при таком переходе испытывают резкое изменение. [40]
Страницы: 1 2 3