Первый ионизационный потенциал
Cтраница 2
Электронодонорную способность молекул можно характеризовать величиной первого ионизационного потенциала, чем он меньше, тем сильнее проявляются электронодонорные свойства. Установлено, что при ионизации кислород -, азот -, серу-или галогенсодержащих молекул удаляется электрон свобод-лой пары, который принимает участие в образовании Н - связи. Но и потенциал ионизации не может быть универсальной характеристикой электроноданорной способности: так, по мере застройки оболочек атома электронами энергия связи электронов с атомом уменьшается, но уменьшение / не сопровождается увеличением злектронодонорной способности. [16]
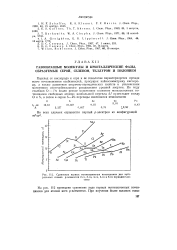 |
Сравнение первых ионизационных потенциалов для нейтральных атомов р-элементов 2-го, 3-го, 4-го, 5-го и 6-го периодов Системы. [17] |
На рис. 112 приведено сравнение хода первых ионизационных потенциалов для атомов всех р-элементов. [18]
Очевидно, что для каждого элемента наименьшим будет первый ионизационный потенциал, так как отделение второго электрона производится уже не от нейтрального атома, а от положительно заряженного иона, что требует затраты большего количества энергии. [19]
Так, от А1 к Ga атомный радиус несколько уменьшается, а первый ионизационный потенциал возрастает. На свойствах атомов таллия, кроме того, сказывается и / - сжатие. Именно поэтому радиус атома TI близок радиусу атома In, а энергия ионизации несколько выше. [20]
Как объяснить, что цирконий и гафний, имеющие сравнительно невысокие значения первых ионизационных потенциалов и отрицательные значения стандартных электродных потенциалов, при обычных условиях химически инертны и коррозионно устойчивы. [21]
 |
Взаимосвязь между энергиями акти - в некоторых минералах. [22] |
Взаимосвязь между диэлектрической проницаемостью диэлектриков и энергией запрещенной зоны, отнесенной к первому ионизационному потенциалу [579], можно рассматривать как пример второго метода сравнительного расчета, в котором комплекс свойств сравнивается с простым свойством в функциональной шкале. [23]
Подобно фтору и хлору водород газообразен; молекулы Н2 и Г2 двухатомны; первые ионизационные потенциалы атомов водорода и галогенов близки между собой; по свойствам водород и галогены - неметаллы; атомы водорода легко замещаются галогенами в органических соединениях. Водород имеет меньшее сродство к электрону и меньшую электроотрицательность, чем галогены. У водорода сильнее выражены восстановительные свойства, чем окислительные. Для галогенов наиболее характерны окислительные свойства. [24]
Энергия, необходимая для отрыва одного из внешних электронов нейтрального атома, представляет собой первый ионизационный потенциал атома элемента. Величина ионизационного потенциала для отрыва каждого из последующих электронов возрастает. [25]
Соединения элементов, у которых работа выхода для первого электрона меньше 4 эв и первый ионизационный потенциал меньше 7 в, например соединения титана, хрома, ванадия и циркония, при реакции с алкилами металлов дают наилучшие катализаторы Циглера. [26]
Инертные газы имеют заполненные внешние 2р6 - оболочки с шестью внешними спиново-связан-ными электронами и высокие первые ионизационные потенциалы при значениях электроотрицательностей, равных нулю. Вследствие этого ни в твердом, ни в жидком состоянии атомы инертных газов не отделяют электронов и не образуют ковалентных связей. [27]
Принципиальная возможность возникновения подобных соединений до известной степени понятна с учетом того, что значения первых ионизационных потенциалов ксенона и радона меньше, чем у некоторых обычных не инертных элементов. Однако свойства XeF4 и XeFe говорят за то, что связи между атомами ксенона и фтора являются в основном ковалентными. [28]
В аллиловых и бензиловых сульфидах действует особый эффект сопряжения, повышающий основность атома серы и понижающий первый ионизационный потенциал молекулы. [29]
В аллиловых и бензиловых сульфидах действует особый эффект сопряжения, повышающий основность атома серы и понижающий первый ионизационный потенциал молекулы. Этот эффект ( W-ад-лильное сопряжение) примерно на порядок слабее р - сопряжения, действующего вое, - ненасыщенных сульфидах. [30]
Страницы: 1 2 3 4