Наблюдаемый потенциал
Cтраница 1
Наблюдаемый потенциал стремится к менее благородному значению, чем вычисленное значение для обратимой реакции. Тем не менее полезно знать направление ожидаемого изменения потенциала, например в случае изменения давления кислорода. [1]
Фактически наблюдаемые потенциалы, при которых возможно восстановление кислорода, гораздо более отрицательные. [2]
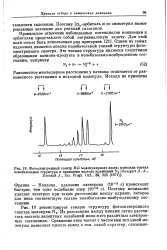 |
Фотоэлектронный спектр Не. молекулярного азота. показана тонкая. [3] |
Правильное отнесение наблюдаемых потенциалов ионизации к орбиталям представляет собой нетривиальную задачу. Одним из самых надежных является анализ колебательной тонкой структуры фотоэлектронного спектра. [4]
К тому же наблюдаемый потенциал ртутного капающего электрода и поверхностные концентрации окисленных или восстановленных частиц являются усредненными величинами в течение времени жизни капли ртути. [5]
В действительности, наблюдаемые потенциалы ионизации бутена-2 и изобутилена очень близки. Именно это расхождение и было одной из причин, которые заставили Стрейтвизера и Найра отвергнуть индуктивную модель. Аналогичная трудность возникает в случае ксилолов, где метод Хюккеля предсказывает значительно больший потенциал ионизации для жега-изомера, чем для двух остальных. В действительности же наблюдаемые потенциалы ионизации всех трех изомеров очень близки. Эти соображения показывают, что причиной неуспеха индуктивной модели Хюккеля может быть просто то обстоятельство, что она переоценивает поляризуемости связей и что лучшим приближением может быть полное пренебрежение индуктивной поляризацией я-электронов под влиянием алкильных заместителей. [6]
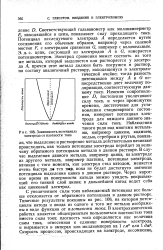 |
Зависимость потенциала электрода от плотности тока. [7] |
С увеличением силы тока наблюдаемый потенциал все больше отклоняется от обратимого потенциала в данном растворе. Типичные результаты показаны на рис. 108, на котором потенциалы катода и анода из одного и того же металла изображены в виде функции от плотности тока. [8]
Усиленный разряд ионов Н сдвигает наблюдаемый потенциал в область более положительных значений, чем величина равновесного потенциала металла. Это основная причина необратимости потенциалов для таких металлов, как барий, стронций и кальций, образующих сравнительно растворимые гидроокислы. [9]
Однако эксперимент этого не подтверждает, так как наблюдаемый потенциал разложения под давлением ниже, чем при атмосферном давлении. Это объясняется снижением потерь, связанных с необратимыми процессами, уменьшением газонаполнения и увеличением электропроводности раствора. Все эти процессы увеличивают деполяризацию электродов растворенными газами. [10]
Во многих случаях реакции электролиза не являются обратимыми и наблюдаемый потенциал распада превышает величину, вычисляемую из термодинамических данных. Этот избыточный потенциал, называемый потенциалом перенапряжения, зависит от площади поверхности электродов и их состояния ( например, шероховатости), наличия примесей в растворе и плотности тока, протекающего через раствор. [11]
Комбинируя потенциал появления трифторметильного иона из октафтортолуола с непосредственно наблюдаемым потенциалом ионизации, находят верхний предел энергии диссоциации экзоциклической связи углерод - углерод в октафтортолуоле, равный 4 8 эв. [12]
Комбинируя потенциал появления трифторметильного иона из октафтортолуола с непосредственно наблюдаемым потенциалом ионизации, находят верхний предел энергии диссоциации экзоциклической связи углерод-углерод в октафтортолуоле, равный 4 8 эв. [13]
Предполагая, что электрохимическая реакция восстановления Pt304 протекает с незначительным перенапряжением, и приравнивая наблюдаемый потенциал этой реакции ( ф 0 27 в) к нормальному, мы вычислили свободную энергию образования окисла AZpt8ou оказавшуюся равной - 176 96 ккал / моль. Подтверждением правильности предполагаемых процессов, происходящих по реакциям ( 4) и ( 5), может служить экспериментально наблюдаемая зависимость потенциала начала восстановления Pt3O4 от рН раствора. [14]
Реакция перекиси водорода [ реакция ( 7) табл. 2 ] также не может задавать наблюдаемый потенциал. Даже при значительно более высоких концентрациях Н2О2 ( 10 - 2 моль / л) Устац на платине не определяется перекисноводородной реакцией ( разд. [15]
Страницы: 1 2 3 4