Стандартный электродный потенциал
Cтраница 1
Стандартные электродные потенциалы указывают на относительную возможность восстановления катионов металла на катоде в водных растворах. Благодаря этому можно установить, например, что ионы серебра восстанавливаются значительно быстрее ионов меди. [1]
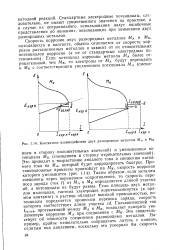 |
Контактное взаимодействие двух разнородных металлов МА и Мк. [2] |
Стандартные электродные потенциалы, следовательно, не имеют существенного значения на практике, а в случае их неправильного использования дадут ошибочные представления об явлениях, возникающих при замыкании двух разнородных металлов. [3]
Стандартный электродный потенциал для реакции ионизации титана с образованием трехвалентных ионов ( что более характерно для активного растворения титана в большинстве условий) равен - 1 21 В. Это значение гораздо более отрицательно, чем потенциалы ионизации таких металлов как железо или цинк, что указывает на большую термодинамическую нестабильность титана по сравнению с этими металлами. Тем не менее, титан коррозионно более стоек, чем железо или цинк. Это зависит в первую очередь от большой склонности титана к пассивации. [4]
Стандартный электродный потенциал ( см.) в неводных растворителях часто мало отличается от такового в воде, хотя различия в степени сольватации ионов могут привести к некоторому его смещению. Для измерения электродных потенциалов в неводных растворителях обычно пригодны электроды сравнения, используемые для водных растворов. Однако при замене растворителя скорости электрохимических реакций могут радикально измениться, поскольку изменятся факторы, определяющие легкость перехода электронов на поверхности электрода. [5]
Стандартный электродный потенциал для реакции ( 59 - 2) равен 0 682 В, а для реакции ( 59 - 3) он составляет 1 77 В. Покажите, что равновесная концентрация перекиси водорода равна примерно 3 2 - 10 - 19 моль / л при парциальном давлении кислорода в одну атмосферу. [6]
Стандартный электродный потенциал этой реакции рзвен 1 358 В ( ст. в. [8]
Стандартный электродный потенциал - потенциал электрода в растворе, в котором ионы, определяющие электродный процесс, имеют активность, равную единице. [9]
Стандартный электродный потенциал - важная физическая константа, являющаяся количественной мерой относительной движущей силы полуреакции. Следует помнить несколько фактов, относящихся к этой константе. Во-первых, электродный потенциал зависит от температуры; если это имеет значение, то должна быть указана температура, при которой определяют потенциал. В-третьих, стандартному электродному потенциалу приписывают знак проводника, находящегося в контакте с изучаемым полуэлементом при конкретных активностях и при условии, что эта ячейка функционирует как гальванический элемент. [10]
Стандартный электродный потенциал этой полуреакции равен, электродному потенциалу при условии, что активности комплекса и лиганда равны единице. [11]
Стандартный электродный потенциал этого элемента, зная, что электродвижущая сила его равна - ( - 0 4586 вольта при 25 С, если ( молярность НО равна 0 0112 и летучесть На равна единице. [12]
Стандартный электродный потенциал для реакции ( 59 - 2) равен 0 682 В, а для реакции ( 59 - 3) он составляет 1 77 В. Покажите, что равновесная концентрация перекиси водорода равна примерно 3 2 - 10 - 19 моль / л при парциальном давлении кислорода в одну атмосферу. [13]
Стандартный электродный потенциал ( standard electrode potential) - обрдтимый потенциал электродного процесса, при котором все продукты находятся и все реакции идут при активностях, равных единице; оценивается по шкале, для которой потенциал стандартного водородного полуэлемента равен нулю. [14]
Стандартные электродные потенциалы этих металлов находятся в интервале между значениями двух электродных потенциалов, характеризующих окисляющее действие кислорода в нейтральной и кислой средах. [15]
Страницы: 1 2 3 4
