Стандартный электродный потенциал
Cтраница 2
Стандартный электродный потенциал устанавливают относительно избранного эталона. [16]
Стандартные электродные потенциалы равны для: Fe2 / Fe3 0 77 В; Мп2 / Мп02 1 23 В, РЬ2 / Ро02 - К 1 45 В. [17]
Стандартный электродный потенциал - числовое значение электродного потенциала, измеренное в стандартных условиях относительно стандартного водородного электрода. [18]
 |
Некоторые сведения о / - элементах I группы периодической системы Д. И Менделеева. [19] |
Стандартные электродные потенциалы - элементов I группы ( см. рис. 11.5. и табл. 11.6) наиболее положительные среди металлов своего периода. Вследствие этого эти металлы имеют достаточно высокую химическую стойкость, которая возрастает при увеличении атомного номера элемента от меди к золоту. Серебро и золото в природе встречаются в самородном виде, они не окисляются на воздухе. Медь, взаимодействуя с кислородом во влажном воздухе, покрывается пленкой СиНСОз зеленого цвета. С разбавленными кислотами ( НС1 и H SO t) эти металлы не реагируют. При комнатной температуре медь взаимодействует с галогенами, серой, медь и серебро - с НзЗ, HaSC ( конц) э НМОз. В отсутствие окислителей эти металлы не растворяются в растворах щелочей. [20]
Стандартный электродный потенциал имеет положительный знак, если его потенциал более положителен, чем потенциал стандартного водородного электрода, и отрицательный знак, если его потенциал более отрицателен, чем водородный. При этом положительным является электрод, на котором происходит восстановление, а отрицательным такой, на котором происходит окисление. Согласно принятой системе знаков процесс самопроизвольно протекает тогда, когда ЭДС элемента положительна. [21]
Стандартные электродные потенциалы этих элементов изменяются в пределах - 2 71 - - 3 02 в, что значительно отрицательнее потенциала восстановления воды. [22]
Стандартные электродные потенциалы этих металлов отрицательны ( - 1 4 и - 1 5 б); по восстановительной активности они близки к алюминию и относительно легко окисляются. [23]
Стандартный электродный потенциал - электродный потенциал, измеренный или вычисленный для условия равенства единице активности каждого компонента электродной реакции. [24]
Стандартный электродный потенциал для реакции Ir - L 1т3 ЗЭ при 25 С равен 1 0 в. Он устойчив в кипящей царской водке и не растворяется в расплаве свинца. [25]
Стандартный электродный потенциал для реакции 1г 1г3 30при 25 С равен 1 0 В. Иридий устойчив в кипящих бромистоводородной и уксусной кислотах, в растворах HgClz, CuSO4, Ala ( 804) 3, а также в кипящей царской водке; не растворяется в расплаве свинца. [26]
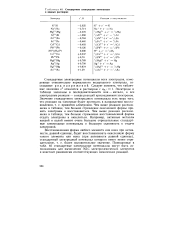 |
Стандартные электродные потенциалы в водных растворах. [27] |
Стандартные электродные потенциалы всех электродов, измеренные относительно нормального водородного электрода, составляют ряд напряжений. Электроды в таблице записаны в последовательности ион - металл, а все электродные реакции - в виде реакций присоединения электронов. Чем ниже реакция расположена в таблице, тем больше стремление окисленной формы принять электроны и восстановиться. Чем выше реакция расположена в таблице, тем больше стремление восстановленной формы отдать электроны и окислиться. Например, активные металлы натрий и калий имеют очень большие отрицательные стандартные электродные потенциалы и большую склонность к отдаче электронов. [28]
 |
Шкала коррозионной стойкости никеля и его сплавов. [29] |
Стандартный электродный потенциал никеля Ni2 2е Ni равен - 0 25 В. [30]
Страницы: 1 2 3 4