Стандартный электродный потенциал - металл
Cтраница 3
ЛОш) метлп ( т) - изменение стандартного изобарно-изо-термического потенциала образования труднорастворимого в воде электролита, кал / моль; А0 е FnV Men и Д0, - - изменение стандартных изобарно-изотермических потенциалов образования водных ионов, кал / г-ион; V Mlfl - стандартный электродный потенциал металла в водном растворе при 298К, В; аМеП и алт - - активности катиона Меп и аниона Ат -, г-ион / л; ЬметАп - произведение растворимости. [31]
Поскольку потенциал стандартного электрода неизвестен, было принято, что нулевой потенциал имеет водородный электрод. Стандартные электродные потенциалы металлов определяют исходя из нулевого потенциала водородного электрода. Таким образом, более активные металлы имеют более отрицательные электродные потенциалы. Несмотря на то, что шкала потенциалов имеет важное теоретическое значение ( см. вступление к гл. Поэтому в каждом конкретном случае потенциалы необходимо устанавливать опытным путем. [32]
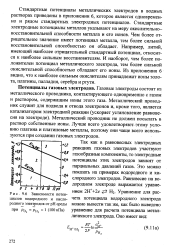 |
Зависимости потенциалов водородного и кислородного электродов от рН среды. [33] |
Стандартные потенциалы металлических электродов в водных растворах приведены в приложении 6, которое является одновременно и рядом стандартных электродных потенциалов. Стандартные электродные потенциалы металлов указывают на меру окислительно-восстановительной способности металла и его ионов. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. Из приложения 6 видно, что к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. [34]
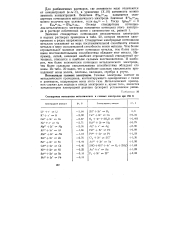 |
Стандартные потенциалы металлических и газовых электродов при 298 К. [35] |
Значения стандартных потенциалов металлических электродов в водных растворах приведены в табл. 20, которая является одновременно и рядом напряжения. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металла и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают его ионы. Из табл. 20 видно, что к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. [36]
Стандартные потенциалы металлических электродов в водных растворах приведены в табл. VII. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металла и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. [37]
Для сравнительной характеристики металлов пользуются понятием - стандартный электродный потенциал металла. Стандартным электродным потенциалом металла называют разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией 1 г-ион металла в литре, и нормальным водородным электродом. [38]
Рассмотрим, как будет протекать восстановительный процесс а катоде в водных растворах. Руководствуясь таблицей стандартных электродных потенциалов металлов, можно указать следующие. [39]
Чем меньше алгебраическая величина стандартного электродного потенциала металла, тем характернее для него ионное состояние и тем труднее восстанавливаются его ионы на катоде. [40]
Для физико-химиков, специалистов по химическим источникам тока, инженеров-конструкторов и технологов электрохимических производств, химиков-аналитиков, равно как и для специалистов ряда других профилей, большой интерес представит разд. V, в котором собраны значения стандартных электродных потенциалов металлов и большого числа окислительно-восстановительных систем не только в водных, но и в неводных средах и ионных расплавах. Для ряда электродов сравнения, особенно широко используемых на практике, даны значения электродных потенциалов при разных температурах. Приведены значения диффузионных потенциалов как на границах раздела одинаковых водных растворов с различной концентрацией, так и на границах раздела разных водных растворов с одинаковой концентрацией. Обобщены и приведены в виде таблиц имеющиеся в литературе данные по величинам потенциалов нулевого заряда ряда металлов, и не только для водных растворов, но и для ионных расплавов. [41]
Если пластинку металла, погруженную в раствор его соли с активностью ионов, равной единице, соединить со стандартным водородным электродом, как показано на рис. 62, то получится гальванический элемент ( электрохимическая цепь), электродвижущую силу ( ЭДС) которого легко измерить. ЭДС, измеренная при 25 С, и будет величиной стандартного электродного потенциала металла. [42]
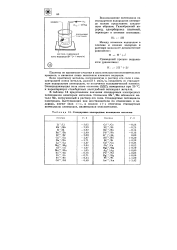 |
Стандартные электродные потенциалы металлов. [43] |
Электродвижущая сила этого элемента ( ЭДС), измеренная при 25 С, и характеризует стандартный электродный потенциал металла. [44]
Впрочем, путь от идеи до ее воплощения, как известно, нередко сложен и извилист. Кроме того, прежде чем перейти к рассказу о возможностях и достижениях неводного электролиза, необходимо остановиться на стандартных электродных потенциалах металлов в неводных растворах. [45]
Страницы: 1 2 3 4