Высокий электродный потенциал
Cтраница 1
Высокие электродные потенциалы, которые должен выдерживать электрокатализатор восстановления кислорода без заметного разрушения, ограничили выбор катализаторов ( за некоторыми исключениями) благородными металлами и их сплавами. [1]
Высокий электродный потенциал цинка обусловливает его взаимодействие с кислородом воздуха, в результате чего в атмосферных условиях на поверхности цинка образуются окисные и гидроокисные соединения. Это является итогом специфичной химической коррозии цинка, в результате взаимодействия последнего с парами различных органических летучих кислот ( муравьиной, уксусной и др.), выделяющихся при высыхании масляной краски, олифы и различных масляных лаков. [2]
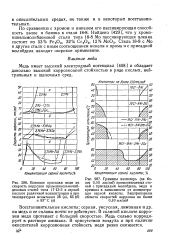
Медь имеет высокий электродный потенциал [408] и обладает довольно высокой коррозионной стойкостью в ряде кислых, нейтральных и щелочных сред. [4]
Значительно реже применяются металлы, имеющие высокий электродный потенциал - серебро, золото. [5]
Значительно реже применяются металлы, имеющие высокий электродный потенциал - серебро, золото. [6]
При катодной защите металла покрытие обладает более высоким электродным потенциалом, чем основной металл. [7]
Хотя хромоникелевые и хромоникелемолибденовые стали и обладают высоким электродным потенциалом, но они не свободны от гальванической ( контактной) коррозии. Последняя возникает, в частности, при контакте с углем и графитом, которые в последнее время широко применяются в химическом машиностроении. [8]
Хотя хромонйкелевые и хромоникелемолибденовые стали и обладают высоким электродным потенциалом, но они не свободны от гальванической ( контактной) коррозии. Последняя возникает, в частности, при контакте с углем и графитом, которые в последнее время широко применяются в химическом м ашиностроении. [9]
Например, алюминий окисляется легче железа и обладает более высоким электродным потенциалом. Эта пленка является нерастворимой в воде, изолирует поверхность металла от соприкосновения с ней и с воздухом, затрудняет или полностью прекращает дальнейшее взаимодействие. [10]
Имеются доказательства того, что в водных растворах при высоких электродных потенциалах [ например, более 0 6 в ( в. Вопрос о природе этого покрытия является спорным. [11]
Полученные экспериментальные данные показывают, что для получения оптимального выхода этиленхлоргидрина необходим высокий электродный потенциал. Низкий электродный потенциал способствует образованию этиленгликоля. В этом случае этилен, по-видимому, является более хорошим деполяризатором для кислорода, чем для хлора; это и объясняет окисление этилена до соответствующего ему гликоля при низком потенциале. [12]
Определение содержания металлического железа основано на взаимодействии его с ионами металла, имеющего более высокий электродный потенциал. С этой целью навеску губчатого железа обрабатывают [170] нейтральным раствором сернокислой меди. Металличеркое железо при этом переходит в раствор в двухвалентной форме, а медь выделяется в элементарном состоянии эквивалентно перешедшему в раствор железу. Количество металлического железа устанавливают путем определения двухвалентного железа в растворе перманганатным методом. Окислы железа при этой обработке остаются без изменения. [13]
Образованный таким образом сульфид железа представляет собой темный порошок ( окалину), имеющий более высокий электродный потенциал, чем железо. В присутствии воды образуется гальванический элемент; ток движется в направлении от электрода Fe к FeS; в результате электролитической коррозии могут появиться сквозные раковины. Выделившийся при образовании FeS водород вызывает определенную опасность. Он диффундирует в сталь и, проникая в кристаллическую решетку железа, значительно снижает ее упругость. Это явление называется водородной хрупкостью. [14]
Для работы в агрессивных средах применяют специальные легированные чугуны ( см. ниже), обладающие высоким электродным потенциалом, способностью создавать пассивирующую пленку и пониженным количеством микрогальванических пар. В водопроводной воде коррозии чугуна возрастает до 1800 г / м2 в год; в морской воде она вдвое больше, чем в водопроводной. [15]
Страницы: 1 2 3