Высокий электродный потенциал
Cтраница 2
Y - f - c - - - M) - Таким образом, системы с более высокими электродными потенциалами восстанавливаются системами с более низкими электродными потенциалами. Это значит, что достаточно одного взгляда на относительное положение1 дву. [16]
При электролизе растворов солей цинка не должно было бы происходить выделение металла, так как цинк имеет значительно более высокий электродный потенциал, чем водород. По теоретическим соображениям, однако, для выделения водорода на цинковом электроде необходим дополнительный потенциал, который называют перенапряжением. Перенапряжение водорода на цинковом электроде столь велико, что в первую очередь происходит выделение цинка, а не водорода. В реальных условиях эти процессы происходят параллельно, в результате чего водород нарушает кристаллическую структуру цинка вследствие проникновения внутрь кристаллов выделяющегося металла и внедрения как в массу кристаллов, так и между кристаллами цинка. В обоих случаях прочность металла падает и он приобретает хрупкость. [17]
Азотированный слой устойчив против коррозии в атмосфере, водопроводной воде, перегретом паре и других средах, что объясняется высоким электродным потенциалом ( - 0 1 - 0 13 мВ), которым обладает только 8-фаза, поэтому для получения надежной защиты от коррозии необходимо образование на поверхности плотного слоя е-фазы. [18]
При электролизе растворов оксокислот или их солей с инертным анодом ( обычно Pt, графит, уголь) на последнем выделяется кислород, что связано с высокими электродными потенциалами оксоанионов. Ионы С1 -, Br -, I -, S2 - разряжаются на аноде при электролизе не очень сильно разбавленных растворов. [19]
Высокое сопротивление коррозионно-усталостному разрушению кратковременно азотированной стали объясняется двумя причинами: 1) большими ( 30 KzjMM2) остаточными напряжениями сжатия в азотированном слое и 2) высокими антикоррозионными свойствами ( отсутствие пор, высокий электродный потенциал) азотированной поверхности, особенно а водопроводной воде. [20]
Благодаря высокому электродному потенциалу сурьму легко выделить электролитическим путем. [21]
Наиболее часто используют медные заземляющие стержни диаметром 19 1 мм, конструкции которых изображены на рис. 5.3. Медь применяют благодаря ее высокой электропроводности и коррозийной стойкости. Однако поскольку медь имеет более высокий электродный потенциал, чем другие металлы, из которых изготовляют сооружения и трубы для подземных коммуникаций, то в системе заземления возникнет коррозия. Для защиты от коррозии целесообразно покрывать стержни материалами, имеющими: электродный потенциал ниже, чем у металлов объектов, расположенных вблизи заземлителей; высокие электропроводность и коррозийную стойкость; гальваническое соответствие базовому материалу стержня. [22]
Более глубокая очистка достигается, если в расплаве диспергирован металл с более высоким электродным потенциалом, чем у железа, но не выше чем у алюминия. [23]
Чтобы графически представить реакции металла во всем диапазоне значений рН при разных значениях потенциала, следует собрать большое количество данных. Например, железо растворяется с образованием ионов Fea, которые при более высоких электродных потенциалах окисляются до Fe8 в очень кислой среде. Эта реакция представлена на фиг. РеакцияРе Н2О - - FeOHa 1 4 - Н е зависит одновременно от рН и потенциала, поэтому геометрическим местом точек, в которых активности FeOH2 и Fe8 равны, является линия Б ( В) 0 877 - 0 0591 рН [ 49], имеющая наклон - 59 1 мВ / ед. [24]
Особенностью электрохимических процессов при высоких окислительных потенциалах является резко выраженная роль химического взаимо действия с электродом кислородных атомов и радикалов, образующихся при электролизе и обладающих большой химической активностью. Это химическое взаимодействие активных частиц с электродом не только осложняет процессы при высоких электродных потенциалах, но является необходимым условием их протекания и определяет механизм процессов. Химическая специфика в электрохимическом окислении проявляется во взаимодействии поверхностных кислородных ( анионных) соединений с разряжающимся ионом в элементарном электрохимическом акте. Электрическое поле на границе раздела электрод - раствор воздействует ( снижая энергию активации) как на разряжающийся ион, так и на поверхностное кислородное ( анионное) соединение. [25]
При контакте в воде цинка и железа возникает так называемая гальваническая пара. Электроны от цинка как более активного металла переходят на железо, вследствие чего между поверхностью железной пластинки и раствором возникает высокий электродный потенциал, достаточный для вытеснения водорода из воды. [26]
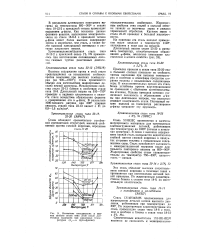 |
Изменение пластических и вязких свойств стали типа 25 - 20 после длительных выдержек при различных температурах ( - - в футо-фунтах. [27] |
В результате длительного повторного ва-грева на температуры 600 - 900 в сталях типа 18 - 12 - 2 с присадкой титана происходит выделение о-фазы. Как показали данные фазового анализа, выделенная электролитически из стали 18 - 8 - 3 с присадкой титана а-фаза имеет более высокое содержание хрома и молибдена, чем сталь, а также более высокий электродный потенциал в растворе хлористого натрия. [28]
В ка честве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. Как уже говорилось, к таким металлам относятся хром, никель-цинк, кадмий, алюминий, олово и некоторые другие. Значительно реже применяются металлы, имеющие высокий электродный потенциал - серебро, золото. [29]
В качестве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. Как уже говорилось, к таким металлам относятся хром, никель, цинк, кадмий, алюминий, олово и некоторые другие. Значительно реже применяются металлы, имеющие высокий электродный потенциал - серебро, золото. [30]
Страницы: 1 2 3