Формальный электродный потенциал
Cтраница 2
Между тем иногда случается и обратное. Формальные электродные потенциалы пар Cu / Cu ( Hg) и Ag / Ag ( Hg) в 0 1 М растворе перхлората тетраэтиламмония в ацетонитриле соответственно составляют - 0 52 и 0 23 В относительно водного НКЭ без диффузионного потенциала ( Т1 в качестве пилотного иона) [5], а стандартные электродные потенциалы этих пар в воде - соответственно 0 15 [166] и больше 0 4 В [160] относительно водного НКЭ. Ацетонитрил комплексует ионы меди ( 1) и серебра ( I) сильнее, чем вода. Эти эффекты известны как специфические и довольно необычны. [16]
Конечно, следует заметить, что необходима особая предосторожность, если при использовании электрохимических методик растворитель нужно сохранять свободным от воды. Для инертных комплексов, когда формальные электродные потенциалы пар лежат в пределах от 1 0 до - 0 7 В относительно водного НКЭ, наличие следов воды в растворителе, вероятно, не имеет большого значения. Между тем для пар с потенциалами вне этой области следы воды играют важную роль и должны быть устранены, если это вообще возможно; 10 - 3 М раствор восстановленной формы обратимой пары, формальный электродный потенциал которой составляет-1 5 В относительно водного НКЭ, будет зачастую устойчив в безводном 1 2-диметоксиэтане, однако, если в растворитель ввести 10 - 2 М воды, восстановленная форма будет быстро окисляться водой. [17]
Очень приблизительно свободная энергия растворения газообразных катионов, кроме иона водорода, в индивидуальном растворителе пропорциональна квадрату заряда иона. Если это так, то разности формальных электродных потенциалов пар в двух растворителях с различными сольватирующими способностями уменьшаются в порядке М3 / М2 М3 / М М3 / М - М2 / М М2 / М М / М при условии, что отсутствуют специфические эффекты. [18]
Химиком-неоргаником редко выполняются электрохимические исследования в водном растворе за пределами области потенциалов от 1 0 до - 1 0 В относительно водного НКЭ. Если в растворе должна быть устойчива восстановленная форма окислительно-восстановительной пары с формальным электродным потенциалом ниже - 1 0 В относительно водного НКЭ, то необходимо использовать растворитель, отличающийся от воды. К растворителям, которые более устойчивы к восстановлению, чем вода, следует отнести ацетонитрил, 1 2-диметоксиэтан, диме-тилформамид, пропиленкарбонат и сульфолан. Меньше известно о растворителях, которые более устойчивы к окислению, чем вода, но фтористый водород и дихлорметан определенно относятся к этой категории. [19]
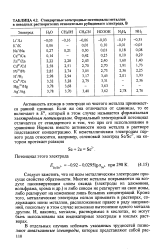 |
Стандартные электродные потенциалы металлов в неводных растворителях относительно рубидиевого электрода, В. [20] |
Активность атомов в электроде из чистого металла принимается равной единице. Если же она отличается от единицы, то ее включают в Е, который в этом случае называется формальным электродным потенциалом. Формальный электродный потенциал отличается от стандартного и тем, что при его использовании в уравнение Нернста вместо активности иона металла в растворе подставляют концентрацию. [21]
Интересно поразмышлять о возможности получения в ацетонитриле или в других растворителях с низкой сольватирующей способностью катионов, которые в водном растворе диспропор-ционируют. Два иона, которые в связи с этим сразу вспоминаются - это ионы меди ( I) и индия ( I), так как имеются надежные данные о формальных электродных потенциалах пар, включающих эти ионы, в водном растворе. [22]
Наконец, важно помнить, что методом с пилотным ионом диффузионные потенциалы только оцениваются, но не определяются точно. Формальные электродные потенциалы в табл. 4 могли быть определены с погрешностью в пределах 100 мВ, так что не имеет смысла интерпретировать на основе термодинамических представлений различия меньше 100 мВ в формальных электродных потенциалах, полученных в разных растворителях. [23]
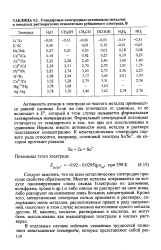 |
Стандартные электродные потенциалы металлов в неводных растворителях относительно рубидиевого электрода, В. [24] |
Активность атомов в электроде из чистого металла принимается равной единице. Если же она отличается от единицы, то ее включают в Е, который в этом случае называется формальным электродным потенциалом. Формальный электродный потенциал отличается от стандартного и тем, что при его использовании в уравнение Нернста вместо активности иона металла в растворе подставляют концентрацию. [25]
Для растворов с концентрацией до 5 М уксусной кислоты в отделении ( 2) потенциал п незначителен. Таким образом, другие формальные электродные потенциалы, отнесенные к уксуснокислому каломельному электроду, можно выразить относительно водного НКЭ без диффузионного потенциала. [26]
В этом обзоре под инертным комплексом подразумевается комплекс, который не легко диссоциирует в растворе. Он противопоставляется неустойчивому комплексу. Окислительно-восстановительное поведение таких комплексов часто простое; формальные электродные потенциалы можно получить непосредственно из потенциометрических, полярографических, вольтам-перометрических и хронопотенциометрических данных. [27]
Потенциалы полуволны для восстановления некоторых простых катионов в воде и неводных растворителях приведены в табл. 4 относительно водного НКЭ без диффузионного потенциала. Таким образом, эти значения могут быть приняты как формальные электродные потенциалы. В значения потенциалов полуволн были внесены поправки на диффузионные потенциалы при использовании метода с пилотным ионом - ионом таллия. [28]
Конечно, следует заметить, что необходима особая предосторожность, если при использовании электрохимических методик растворитель нужно сохранять свободным от воды. Для инертных комплексов, когда формальные электродные потенциалы пар лежат в пределах от 1 0 до - 0 7 В относительно водного НКЭ, наличие следов воды в растворителе, вероятно, не имеет большого значения. Между тем для пар с потенциалами вне этой области следы воды играют важную роль и должны быть устранены, если это вообще возможно; 10 - 3 М раствор восстановленной формы обратимой пары, формальный электродный потенциал которой составляет-1 5 В относительно водного НКЭ, будет зачастую устойчив в безводном 1 2-диметоксиэтане, однако, если в растворитель ввести 10 - 2 М воды, восстановленная форма будет быстро окисляться водой. [29]
ДОсольв, происходит параллельно с уменьшением его диэлектрической постоянной и увеличением - ДСион. Это приводит к двум противоположно действующим членам свободной энергии. Обычно при переходе от растворителя с большей сольватирующеи способностью к растворителю с меньшей сольватирующеи способностью изменение АСиоа. АОСОЛьв, и поэтому значения формальных электродных потенциалов пар, образованных по крайней мере из одного катиона, становятся, подобно значениям стандартных электродных потенциалов, более положительными по мере уменьшения сольватирующеи способности растворителя. [30]
Страницы: 1 2 3