Химический потенциал - растворитель
Cтраница 2
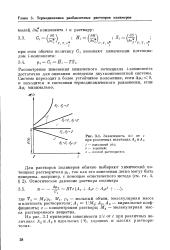 |
Зависимость я / с от с при различных величинах A2v. A3. [16] |
Для растворов полимеров обычно выбирают химический потенциал растворителя fib так как его изменения легко могут быть измерены, например, с помощью осмотического метода ( см. гл. [17]
В предыдущих примерах все определялось химическим потенциалом растворителя, который в случае разбавленных растворов совпадает с химическим потенциалом растворителя в идеальной смеси. [18]
 |
Зависимость коэффициента активности тростникового сахара ( / и хлорида лития ( 2 от их концентрации в водном растворе. [19] |
Полная свободна я энергия раствора и химический потенциал растворителя не зависят от конкретных представлений о природе диссоциации. [20]
H J O, т е химический потенциал растворителя в растворе) и в чистом виде ( Л2) совпадает. Другими словами, в таких условиях раствор полимера ведет себя подобно идеальноИу - ТГ 5 Во15о7Гна1я энергия смешения в первом. [21]
Это частичное равновесие таково, что химический потенциал растворителя одинаков по обе стороны от мембраны, тогда как химические потенциалы растворенных веществ различны и не могут уравняться из-за ее наличия. В классическом лекционном опыте, демонстрирующем осмотическое давление, водный раствор солей 1 отделяют от чистой воды 2 куском бычьего пузыря ( фиг. Вода проникает внутрь полости 1 и повышает уровень в манометрической капиллярной трубке, пока гидростатическое давление не уравновесит диффузию чистой воды в раствор. [22]
Первый член скобки представляет собой величину химического потенциала растворителя для идеального раствора. Второй член описывает отклонения от идеальности, обусловленные особенностями структуры полимерных молекул. Величина % является параметром, специфичным для данной системы полимер - растворитель и называется обычно параметром взаимодействия. [23]
Изменение температуры кипения ДТ раствора объясняется изменением химического потенциала растворителя при добавлении в него примеси. [24]
Следовательно, осмотический коэффициент равен отношению изменения химического потенциала растворителя ( Ац ц - ц, ) при образовании неидеального раствора сильного электролита данного состава к изменению химического потенциала растворителя при образовании идеального раствора с такой же концентрацией сильного электролита. [25]
Условием равновесия между двумя растворами является равенство химических потенциалов растворителя в них при равной температуре и давлении. Это условие не распространяется на растворенное вещество вследствие наличия полупроницаемой мембраны. Растворение вещества приводит к снижению химического потенциала растворителя. Таким образом, в начальный момент времени химические потенциалы растворителя неодинаковы по обе стороны перегородки. [26]
Это уравнение легко перевести в выражение для химического потенциала растворителя. [27]
Изменение температуры кипения ДГ раствора объясняется изменением химического потенциала растворителя при добавлении в него примеси. [28]
Следовательно, осмотический коэффициент равен отношению изменения химического потенциала растворителя ( Дщ Hi - ц У) при образовании неидеального раствора сильного электролита данного состава к изменению химического потенциала растворителя при образовании идеального раствора с такой же концентрацией сильного электролита. [29]
Изменение температуры кипения ДГ раствора объясняется изменением химического потенциала растворителя при добавлении в него примеси. [30]
Страницы: 1 2 3 4