Замена - остаток
Cтраница 2
Оказалось, что и прямое действие на ферроценборную кислоту медных ( Си11) солей карбоновых кислот ( 17), а также медных М - про-изводных, подобных фтальимиду меди ( 18), приводит к замене остатка борной кислоты на анион. [16]
Из природных источников, а также путем специальных опытов с образующими витамин Bi2 микроорганизмами ( которым давали предшественники витамина Ви или его аналогов) удалось выделить большое число сходно построенных соединений, отличающихся либо заменой группы CN на дру-тие группировки ( нитрогруппу, оксигруппу и др.), либо заменой остатка диметилбензимидазола на сходные группировки. Ни одно из этих соединений не превосходит цна кобаламин по активности. [17]
Ондетти [1663] синтезировал СН9 - брадики-нин точно таким же путем, который применяли для синтеза СМ - С - брадикинина ( ср. Замена остатка Arg9 на остаток цитруллина вызывает снижение активности в отношении действия на изолированную матку крысы в 400 раз, а в отношении действия на кровяное давление у крысы - в 100 раз. Испытания на сердце кошки in vitro ( расширение коронарных сосудов) показали, что в этом тесте активность СК9 - брадикинина составляет 1 / 20 активности брадикинина. [18]
Изменение конфигурации - ( о - РЬе8 - брадикинин ( XXXV) [ 1615а, 1617 ]), замещение атома водорода в / шра-положении ароматического кольца на атом фтора ( Рпе ( Р) 8-брадикинин ( XXXVI) [ 1615а, 1617 ]) и одновременное изменение конфигурации и пара-замещение ( в - РЬе ( Р) 8-брадикинин ( XXXVII) [ 1615а, 1617 ]) сопровождаются сравнительно небольшим снижением активности ( 1 / 5 - 1 / 3 активности брадикинина) в испытаниях на понижение кровяного давления у морских свинок. Замена остатка фенилаланина на остаток неароматической аминокислоты ( А1а8 - брадикинин ( XXXIV) [ 1969, 1969а ]) приводит к очень резкому снижению активности. Так, гипотензивная активность ( в опытах на кроликах) уменьшается по сравнению с брадикинином приблизительно в 1000 раз. [19]
Активность О1у5 - эледоизина и О1у5 - Уа18 - эледоизина составляет соответственно 90 и 80 % активности природного гормона. Замена остатка изолейцина на остаток лейцина приводит к десятикратному снижению активности. [20]
Сильные инсектицидные и нематоцидные свойства обнаружены у О-алкил - О-арил - 5-пропилдитиофосфатов, некоторые из них получили достаточно широкое практическое применение. Замена пропильного остатка на другие приводит к резкому снижению инсектицидности, а в некоторых случаях и к повышению токсичности для млекопитающих. [21]
Сильные инсектицидные и нематоцидные свойства обнаружены у 0-алкил - 0-арил - 5-пропилдитиофосфатов, некоторые из них получили достаточно широкое практическое применение. Замена пропильного остатка на другие приводит к резкому снижению инсектицидности, а в некоторых случаях и к повышению токсичности для млекопитающих. [22]
Наиболее коротким пептидом, все еще обладающим активностью ( 1 %), является С-концевой пентапептид ( XVI) ( формулы соединений, пронумерованных римскими цифрами, см. в табл. 5а), а активность гексапептида ( XV) составляет 15 - 30 % активности эледоизина. Однако замена остатка аминокислоты в положении 7 ( LXXXIII-LXXXVI) или 8 ( LXXXIX-XCIII) приводит почти всегда к соединениям с низкой активностью. Практически не влияет на активность замена остатка глицина в положении 9 ( CVIII-СХ); с другой стороны, замена остатка метионина, занимающего положение 11, приводит почти всегда к образованию неактивных соединений. Гептапеп-тид ( VIII) и его аналоги ( L-LXII), полученные путем замены аминокислотного остатка в положении 5, всегда проявляют высокую активность, которая практически не зависит от природы введенного аминокислотного остатка. [23]
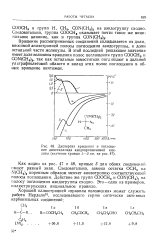 |
Дисперсия вращения и поглощение диметиламида азидопропионовой кислоты ( значение кривых / - 5 на 47. [24] |
Как видно из рис. 47 и 48, кривые 5 для обоих соединений имеют разный знак. Следовательно, замена остатка ОСН3 на N ( CH3) 2 коренным образом меняет анизотропию соответствующей полосы поглощения. Действие же групп СООСН3 и CON ( CH3) 2 на полосу поглощения азидогруппы сходно. Это-один из примеров, иллюстрирующих вицинальное правило. [25]
Фенильная группа в положении 3 также необходима для проявления биологической, особенно вазопрессорной активности. Так, замена остатка Phe3 на Ser3 или Try3 ( XIII или XIV) сопровождается полной потерей активности. Интересно, что присутствие в этом положении остатка Туг3 ( XV) также приводит к неактивному аналогу. Отрицательное влияние ароматической гидроксильной группы в положении 3 видно на примере Phe2 - Туг3 - Ьуз8 - вазопрессина ( XX) [288], образующегося при взаимной перестановке остатков фенилаланина и тирозина у природного гормона. Вазопрессин ( VIII) еще сохраняет значительную активность, в то время как Рпе2 - Туг3 - Ьуз8 - вазопрес-син практически неактивен. [26]
Поразительные изменения свойств могут проистекать в результате замены всего лишь одной аминокислоты на другую в молекуле белка. Так, замена остатка глутаминовой кислоты на валин в одной из четырех полипептидных цепей гемоглобина резко изменяет его свойства и приводит к болезни - серповидной анемии. Изменение других аминокислотных остатков может, однако, давать незначительный эффект или вовсе не влиять на биологическую активность. Цитохромы действуют при биологическом окислении как переносчики электронов и один из них, цито-хром с, может быть легко растворен и выделен. Полная аминокислотная последовательность цитохрома с была определена для белков из примерно 40 видов; проведено сопоставление между различными последовательностями, а также с трехмерной ( по данным рентгенографии) моделью цитохрома с сердца лошади. По-видимому, цитохром с не подвержен радикальным эволюционным изменениям, однако отдельные участки ( особенно положения 70 - 80 в последовательности из 104 аминокислот) совершенно неизменны, тогда как другие допускают изменения в довольно широких пределах. Важно, что участок аминокислотной последовательности, ответственный за перенос электронов, содержит шесть или более остатков различных аминокислот в различных видах. [27]
При замещении алифатической гидроксильной группы остатка серина ( положение 6) карбамильной группировкой активность ( кровяное давление у морских свинок) снижается в 75 раз. С другой стороны, замена остатка Ser6 на остаток глицина приводит к соединению XXII [281, 1963, 1969], практически не отличающемуся по своей активности от брадикинина. Биологическое действие А1а6 - брадикинина ( XXI) [ 1969, 1969а ], Thr6 - брадикинина ( XXV) [ 596а, 1973а ] и, что особенно интересно, о - 8ег6 - брадикинина ( XXIV) [ 596а, 1617 ] в отдельных тестах также очень близко в количественном отношении к действию брадикинина. Напротив, замена остатка Ser6 на остаток сарко-зина сопровождается существенным снижением активности; действительно, 5агб - брадикинин ( XXIII) [1969] в 1000 раз менее активен, чем природный гормон. [28]
Уже первые опыты показали, что ЦТМ - и ЦТРборные кислоты отличаются от ферро-ценилборной кислоты и ближе но свойствам к фенилборной кислоте. В то время как замена остатка В ( ОН) 2 на HgCl при действии HgGla происходит легко, замену на G1 и Вг приходится осуществлять длительным нагреванием с водным раствором СиС12 и CuBr2, что, впрочем, дает высокий выход ЦТМС1 и ЦТМВг. [29]
В связи с рассмотрением пептидных инсектицидов должны быть упомянуты исследования Подушки, Сламы и др., занимавшихся ювенильной гормональной активностью обычных пептидных производных. Повышения активности удалось достигнуть заменой остатка изолей - Цина на mpem - бутилоксикарбонильную группу. [30]
Страницы: 1 2 3